
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,由平均摩尔质量=$\frac{m}{n}$来计算,由质量和物质的量的关系列方程解出甲烷的物质的量,再计算混合气体中甲烷的体积和一氧化碳的质量.
解答 解:标准状况下,8.96L气体的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,
混合气体平均摩尔质量为:$\frac{7.6g}{0.4mol}$=19g/mol,
设甲烷的物质的量为x,CO的物质的量为y,
则$\left\{\begin{array}{l}{x+y=0.4mol}\\{16x+28y=7.6g}\end{array}\right.$,
解得:x=0.3mol、y=0.1mol,
则甲烷在标况下的体积为:0.3mol×22.4L/mol=6.72L,
一氧化碳的质量为0.1mol×28g/mol=2.8g,
故答案为:0.4mol;19g/mol;6.72L;2.8g.
点评 本题考查物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 用醋酸溶解碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$NO2 | |
| C. | 生产聚丙烯塑料:nCH=CH-CH3→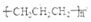 | |
| D. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH5+、-OH、NH3各1mol,所含的电子数均为10NA | |
| B. | 20℃、101kPa条件下,11.2L丁烷中含极性共价键的数目大于5NA | |
| C. | 78gNa2O2和Na2S的固体混合物中含有的阴离子数目一定是NA | |
| D. | 0.1mol•L-1AlCl3溶液中含有Al3+的数目一定小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰和水的反应 | B. | 木炭在氧气中发生不完全燃烧 | ||
| C. | 铝热反应 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 元素X的常化合价是+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
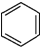
| A. | ②④均能发生加成反应 | B. | ①⑥均能发生取代反应 | ||
| C. | ②③均能使酸性KMnO4溶液褪色 | D. | ④⑤均能与NaOH溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 锌极质量不变 | D. | 铜为原电池正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
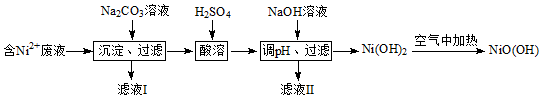
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com