
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;CuH跟盐酸反应能产生气体。以下有关推断中不正确的是
A.“另一种反应物”在反应中表现还原性
B.CuH在化学反应中既可做氧化剂也可做还原剂
C.CuH在氯气中燃烧的化学方程式为CuH+Cl2==CuCl+HCl
D.CuH与盐酸反应生成的气体是H2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届吉林省高三上第二次月考化学试卷(解析版) 题型:选择题
某溶液中含有Cu2+、Mg2+、Fe2+、Al3+等4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加过量盐酸,溶液中大量减少的阳离子是( )
A.Cu2+ B.Mg2+ C.Fe2+ D.Al3+
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上10月月考化学卷(解析版) 题型:推断题
短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正化合价和最低负化合价的绝对值之差为2;1 mol C单质与冷水反应,在标准状况下生成11.2 L H2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)用元素符号表示各元素A________、B_________、C_________、D__________、E_________;
(2)能形成共价键的元素
(3)A的单质的电子式为______________
(4)C和B形成化合物的电子式__________
(5)写出C与水反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上10月月考化学卷(解析版) 题型:选择题
SO2是一种大气污染物,可用NAOH溶液除去,下列有关解释的方程式不合理的是
A.SO2在大气中能最终生成H2SO4:2SO2+O2+2H2O=4H++2SO42-
B.少量SO2与NAOH溶液反应的离子方程式是:SO2+OH-=HSO3-
C.NAOH溶液缓慢吸收过量SO2的过程中有:SO2+SO32-+H2O=2HSO3-
D.n(SO2):n(NAOH)=1:2时,溶液pH>7:SO32-+H2O HSO3-+OH-
HSO3-+OH-
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上10月月考化学卷(解析版) 题型:选择题
硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当SO42-的浓度为0.20 mol·L-1时,加入等体积的0.20 mol·L-1的KOH溶液(混合后溶液 体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是( )
体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是( )
A.0.20 mol·L-1 B.0.25 mol·L-1 C.0.225 mol·L-1 D.0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆、荆、襄、宜四地七校高三上联考一化学卷(解析版) 题型:填空题
荆门天茂实业集团为新能源领域的先行者,在中南地区拥有最大的甲醇装置并已建成年产50万吨二甲醚装置。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及如下反应。
甲醇合成反应:(i)CO(g)+2H2(g) CH3OH(g)△H1=-90.1kJ•mol-1
CH3OH(g)△H1=-90.1kJ•mol-1
二甲醚合成反应:(ii)2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-23.9kJ•mol-1
CH3OCH3(g)+H2O(g)△H2=-23.9kJ•mol-1
(iii)2CH3OH(g) C2H4(g)+2H2O(g)△H3=-29.1kJ•mol-1
C2H4(g)+2H2O(g)△H3=-29.1kJ•mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上以铝土矿制备较高纯度Al2O3的主要工艺流程是(以化学方程式表示) 、 、2Al(OH)3 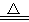 Al2O3 +3H2O。
Al2O3 +3H2O。
(2)一定温度时,反应(i)的平衡常数数值Kp = 4.80×10-2,向容器中充入2 mol H2和1 molCO,反应(i)达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为__________(Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(3)二甲醚合成反应过程中两反应能量变化如图所示:
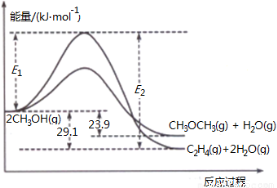
①反应速率较大的是__________(填序号 “ ii”、“ iii”),说明原因 。
②若在容器中加入催化剂,则E2 - E1将__________(填“变大”、“不变”或“变小”)。
(4)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆、荆、襄、宜四地七校高三上联考一化学卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 制备Fe(OH)3胶体 | 将NaOH稀溶液滴加到饱和的FeCl3溶液中 |
B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
C | 证明非金属性:Cl>C>Si | 将盐酸与石灰石反应产生的气体通入硅酸钠溶液 |
D | 除去Cu粉中混有的CuO | 加入稀硫酸,过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省双鸭山市高三月考二化学试卷(解析版) 题型:选择题
已知温度 T 时水的离子积常数为 Kw,该温度下,将浓度为 amol/L 的一元酸HA 与 bmol/L 的一元碱 BOH 等体积混合,可判断该溶液呈中性的依据是:
A.a=b
B.混合溶液的 pH 值为 7
C.混合溶液中C(H+)=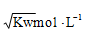
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上期中化学试卷(解析版) 题型:实验题
某研究性小组借助A-D的仪器装置完成有关实验。
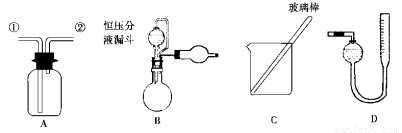
为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH===Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(1)选用B和_____________(填仪器标号)两个装置进行实验。
(2)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=_____________。
(3)计算镀层厚度,还需要检索的一个物理量是_____________。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_____________(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(5)ω(Zn)=____________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙__________方案乙( “优于”、“劣于”或“等同于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com