
2NO2![]() 2NO+O2在密闭容器中进行,达到平衡状态的标志是 ( )
2NO+O2在密闭容器中进行,达到平衡状态的标志是 ( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
科目:高中化学 来源: 题型:
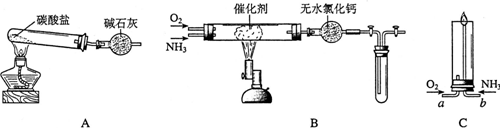
| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:
X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
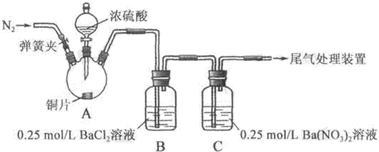
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
| ||
| ||
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
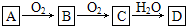
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com