
| A. | 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol | |
| B. | 达到化学平衡状态时,X、Y、Z的浓度不再发生变化 | |
| C. | 达到化学平衡状态时,反应放出的总热量可达a kJ | |
| D. | 升高反应温度,逆反应速率增大,正反应速率减小 |
分析 A、可逆反应不可能完全转化;
B、化学平衡时正逆反应速率相等,体系中各组分的浓度不变;
C、反应热表示1molX和2molY完全反应生成3mol的Z放出aKJ的热量;
D、升高反应温度,正逆反应速率都加快.
解答 解:A、可逆反应不可能完全转化,所以0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol,故A正确;
B、化学平衡时正逆反应速率相等,体系中各组分的浓度不变,所以达到化学平衡状态时,X、Y、Z的浓度不再发生变化,故B正确;
C、反应热表示1molX和2molY完全反应生成3mol的Z放出aKJ的热量,反应放出的热量与实际参加反应的量有关,所以达到化学平衡状态时,只要有1molX参加反应就可以放出aKJ的热量,故C正确;
D、升高反应温度,正逆反应速率都加快,对正逆反应影响是一致的,故D错误;
故选D.
点评 本题考查了化学平衡影响因素和反应热的相关知识,化学平衡状态是正逆反应速率相等,各组分的浓度不变,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的结构式:N=N | B. | F-的结构示意图: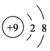 | ||
| C. | 中子数为20 的氯原子:2017Cl | D. | NH3 的电子式: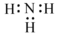 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH3•H2O的pH小于13 | |
| B. | 0.1 mol•L-1 NH4Cl的pH小于7 | |
| C. | 相同条件下,浓度均为0.1 mol•L-1 NaOH溶液和氨水,氨水的导电能力弱 | |
| D. | 0.1 mol•L-1 NH3•H2O能使无色酚酞试液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaClO溶液中,ClO-的数目为0.1NA | |
| B. | 常温常压下,11.2LCH4含有的共用电子对数目为2NA | |
| C. | 16gO2与O3混合气体中,氧原子的数目为1.5NA | |
| D. | 1molFe与足量Cl2完全反应后,转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | B. | c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | ||
| C. | c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | D. | c(Cl-)>c(Na+)>c(HCO3-)>c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com