
分析 (1)MnO2和浓盐酸反应制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,氯气的物质的量为n=$\frac{m}{M}$=$\frac{4.48L}{22.4mol/L}$=0.2mol,根据方程式计算;
(2)4molHCl参加反应有2molHCl被氧化生成1mol氯气,据此分析;
(3)根据2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O以及漂白粉的主要成分是CaCl2与Ca(ClO)2解答.
解答 解:(1)MnO2和浓盐酸反应制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,氯气的物质的量为n=$\frac{m}{M}$=$\frac{4.48L}{22.4mol/L}$=0.2mol,
则消耗MnO2为0.2mol,其质量为0.2mol×87g/mol=17.4g;
答:理论上需要消耗MnO2为17.4g;
(2)4molHCl参加反应有2molHCl被氧化生成1mol氯气,已知反应时生成0.2mol氯气,所以被氧化的HCl为0.4mol;
答:被氧化的HCl为0.4mol;
(3)生成0.2mol氯气,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 111g 143g
0.2mol 11.1g 14.3g
漂白粉的主要成分是CaCl2与Ca(ClO)2,则所得漂白粉的质量为11.1g+14.3g=25.4g,
答:可制得漂白粉为25.4g.
点评 本题综合考查氧化还原反应、有关方程式的计算,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和相关计算,题目难度中等.


科目:高中化学 来源: 题型:多选题
 普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )| A. | 外电路上,电子由Cu电极沿导线流入Ag2O电极 | |
| B. | 测量原理示意图中,Ag2O为负极 | |
| C. | 负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O | |
| D. | 电池工作时,OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中:Na+、K+、SiO32-、CO32- | |
| B. | pH=13的溶液:Ba2+、Na+、I-、ClO- | |
| C. | 苯酚钠溶液中:HSO3-、K+、Na+、AlO2- | |
| D. | 加入淀粉碘化钾溶液显蓝色:Na+、NH4+、SO42-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断:
已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | FeS固体放人稀硝酸溶液中:FeS+2H+═Fe2++H2S↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H20═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  | 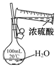 | 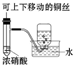 |
| A.制备少量氨气 | B.吸收HCl | C.配制一定浓度硫酸溶液 | D.制备并收集少量NO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为电池的负极,被氧化 | B. | O2为负极,被还原 | ||
| C. | 该电池的总反应是2Zn+O2=2ZnO | D. | 该电池是将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
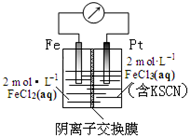
| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e?=Fe | |
| D. | 若转移1mol e-,交换膜左侧溶液中则减少1 molCl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com