
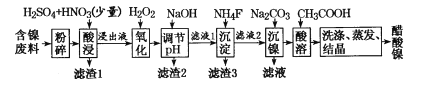
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
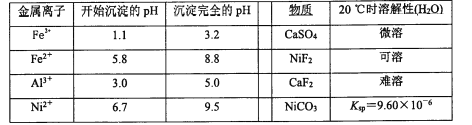
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
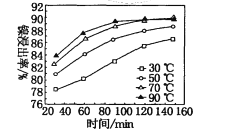
【答案】加快化学反应速率,提高镍的浸出率 NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O 2Fe2++H2O2+2H+═2Fe3++2H2O 5.0≤pH<6.7 CaF2 31.8 70 120
【解析】
含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体。
(1)将含镍原料粉碎可以加快化学反应速率,提高镍的浸出率;
(2)酸浸过程中,1mol NiS被硝酸氧化失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2,其反应的化学方程式为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
(3)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为5.0≤pH<6.7;
(5)由流程以及物质的溶解性分析可知,滤渣3为CaF2;
(6)已知NiCO3的Ksp=1.0×10-5,使100ml该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5mol·L-1],则溶液中c(CO32-)=Ksp/c(Ni2+)=1.0×10-5/10-5mol·L-1=1.0mol·L-1,与Ni2+反应的n(CO32-)=cV=2mol·L-1×0.1L=0.2mol,则加入的碳酸钠的总物质的量n(CO32-)=0.2mol+1.0mol·L-1×0.1L=0.3mol,所以m=n![]() M=0.3mol×106g·mol-1=31.8g;
M=0.3mol×106g·mol-1=31.8g;
(7)由图象可知,为70℃、120min时,酸浸出率最高;


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中错误的是
A.医疗上常用体积分数为70%~75%的酒精作消毒剂
B.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C.海鲜、肉类等食品用福尔马林浸泡防腐保鲜
D.碘沾在手上立即用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
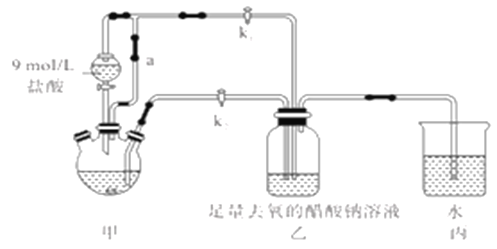
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氧气氧化某浓度Fe2+为Fe3+过程的实验结果,下列有关说法正确的是
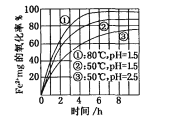
A. pH=1.5时氧化率一定比pH=2.5时大
B. 其他条件相同时,80℃的氧化率比50℃大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水常用二氧化氯(ClO2)来杀菌消毒,它能转化为可溶性氯化物,市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售,为辨别纯净水的真伪,你想选用的化学试剂是( )
A.氯化钡溶液B.石蕊试液C.硝酸银溶液D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分元素,用元素符号或化学式回答下列问题:
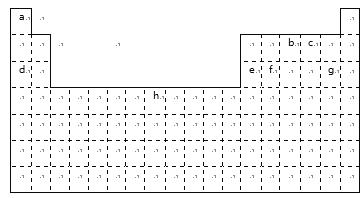
(1)h元素在周期表中的位置是_______;
(2)表中所列元素中,金属性最强的是____;元素最高价含氧酸酸性最强的是____;(填化学式)
(3)c、d、e、g中,离子半径最小的是____;(填离子符号)
(4)a和b化合时形成_____键;a和d化合时形成______键;
(5)由a、c、d形成的化合物的电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
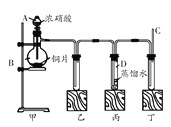
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是 ,该装置中发生反应的化学方程式为 。
(2)实验过程中,装置乙、丙中出现的现象分别是 ;装置丙中的试管内发生反应的离子方程式为 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是 。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为 色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为 色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E元素形成的简单离子是同周期元素中离子半径最小的。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是__________________,C元素在周期表中的位置是_________________________;
(2)C和D的离子中,半径较小的是_____________;(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的离子方程式是______________________________________________________;
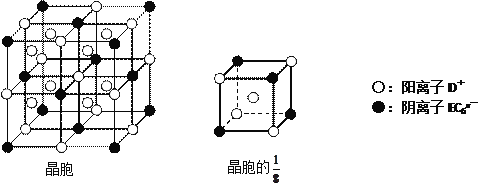
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com