
分析 反应中Fe元素的化合价由+2价升高为+3价,N元素的化合价应降低,结合原子、电子守恒计算.
解答 解:(1)n(FeSO4)=$\frac{11.4g}{152g/mol}$=0.075mol,KNO3的物质的量为0.05L×0.5mol•L-1=0.025mol,设NO3-与NxOy中N元素化合价差为a,根据得失电子总数相等的原则,可得关系式:0.075×1=0.025×a,所以a=3即NxOy中N元素化合价为+2价,NxOy为NO,所以x=y=1,
故答案为:1;1;
(2)N元素的化合价降低,则氧化剂为KNO3,故答案为:KNO3;
(3)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4=3K2SO4+3Fe2(SO4)3+2NO↑+4H2O,反应产物中H2O的化学计量数为4,
故答案为:4.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
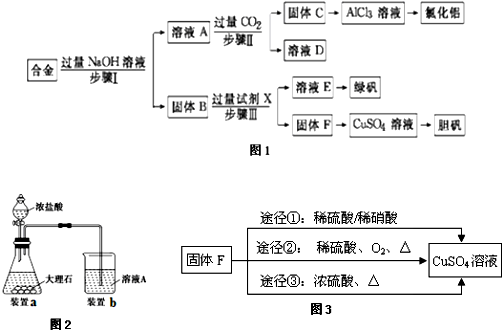
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
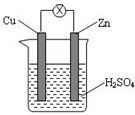
| A. | Zn 是负极,发生还原反应 | B. | Cu 是负极,发生氧化反应 | ||
| C. | Cu 片上有气体逸出 | D. | 电子由 Cu 片通过导线流向 Zn 片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通入 H2电极是负极 | |
| B. | 通入 O2电极发生氧化反应 | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com