
����Ŀ��ˮ�����ؽ���Ǧ����Ⱦ���ⱸ�ܹ�ע��������֪Pb4+���к�ǿ����������ˮ��Ǧ�Ĵ�����̬��Ҫ��Pb2+��Pb(OH)+��Pb(OH)2( ��ˮ���ܽ��С)��Pb(OH)3-��Pb(OH)42-������̬�����ʵ�������a����ҺpH�仯�Ĺ�ϵ����ͼ��ʾ:

�����й�˵����ȷ����
A. Pb(NO3)2��Һ��,c(Pb2+)/c(NO3-)=1/2
B. ��Pb(NO3)2���еμ��Ȼ����Һ,��Һ��c(Pb2+)/c(NO3-)��С��������Cl-��Pb2+������Ӧ
C. ��Pb(NO3)2��Һ�еμ�NaOH��Һ��pH Խ�������ɳ���Խ��
D. pH=12ʱ�������ϵ�з�������Ҫ��Ӧ�����ӷ���ʽΪPb(OH)3-+OH-=Pb(OH)42-
���𰸡�D
��������A����ΪPb(NO3)2��һ��ǿ�������Σ���ˮ��Һ�д�������ˮ��ƽ�⣺2H2O+Pb2+![]() Pb(OH)2+2H+��ʹc(Pb2+)��С������
Pb(OH)2+2H+��ʹc(Pb2+)��С������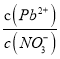 <
<![]() ��ѡ��A����B���Ȼ��ˮ��ʹ������Ũ����������Pb2+ˮ�⣬ƽ��2H2O+Pb2+
��ѡ��A����B���Ȼ��ˮ��ʹ������Ũ����������Pb2+ˮ�⣬ƽ��2H2O+Pb2+![]() Pb(OH)2+2H+�����ƶ���ʹ��Һ��c(Pb2+)����
Pb(OH)2+2H+�����ƶ���ʹ��Һ��c(Pb2+)����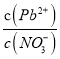 ���ѡ��B����C����ͼ��֪����3����pH��7��10ʱ��Pb(OH)2��������pH>10ʱ��Pb(OH)2�������٣�����Pb(NO3)2��Һ�еμ�NaOH��Һ��pH���������ɳ��������Ӻ���٣�ѡ��C����D��pH=12ʱ������4��Ũ�Ƚϴ��Pb(OH)3-Ũ�����½�������5�е�Pb(OH)42-Ũ��������������Pb(OH)3-ת��ΪPb(OH)42-����Ӧ�����ӷ���ʽΪPb(OH)3-+OH-=Pb(OH)42-��ѡ��D��ȷ����ѡD��
���ѡ��B����C����ͼ��֪����3����pH��7��10ʱ��Pb(OH)2��������pH>10ʱ��Pb(OH)2�������٣�����Pb(NO3)2��Һ�еμ�NaOH��Һ��pH���������ɳ��������Ӻ���٣�ѡ��C����D��pH=12ʱ������4��Ũ�Ƚϴ��Pb(OH)3-Ũ�����½�������5�е�Pb(OH)42-Ũ��������������Pb(OH)3-ת��ΪPb(OH)42-����Ӧ�����ӷ���ʽΪPb(OH)3-+OH-=Pb(OH)42-��ѡ��D��ȷ����ѡD��


 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����Mg��100mL4mol/L�����ᷴӦ������ȫ���ܽ���ټ���2mol/L��NaOH��Һ�����ɳ������ʱ�������������������Һ���Ϊ
A. 200mL B. 250mL C. 300mL D. 400mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�![]() ������ǿ�����ԣ�������ԭΪ����أ���80�����������ֽ⣮ʵ����ģ�ҵ�ϳɹ�����ص��������£�
������ǿ�����ԣ�������ԭΪ����أ���80�����������ֽ⣮ʵ����ģ�ҵ�ϳɹ�����ص��������£�
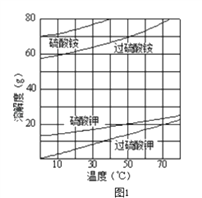
��1������狀��������Ƴɵ��Һ���Բ����缫���е�⣬���ɹ��������Һ��д�����ʱ������Ӧ�����ӷ���ʽ________________________��
��2����֪������ʵ��ܽ��������ͼ1��ʾ����ʵ�������ᴿ������شֲ�Ʒ��ʵ������������Ϊ����������شֲ�Ʒ��������ˮ�У�__________________________�����
��3����Ʒ�й�����صĺ������õ��������вⶨ��ʵ�鲽�����£�
����1����ȡ���������Ʒ0.3000g�ڵ���ƿ�У�����30mLˮ�ܽ⣮
����2������Һ�м���4.000g KI���壨�Թ�������ҡ�ȣ��ڰ�������30min��
����3���ڵ���ƿ�м�������������Һ�ữ���Ե�����Һ��ָʾ������0.1000molL��1 Na2S2O3����Һ�ζ����յ㣬������Na2S2O3����Һ21.00mL������֪��Ӧ��I2+2S2O32��=2I��+S4O62����
��������2��δ������ƿ���ڰ�������30min�����������в���3����ⶨ�Ľ������_______��ѡ�ƫ����ƫС��������Ӱ�족������������3�еζ��յ��������_________��
�ڸ�����������ɼ��������Ʒ�й�����ص���������Ϊ_______��
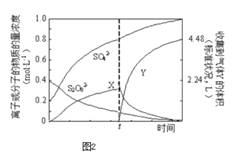
��4����0.40mol���������0.20mol�������Ƴ�1L��Һ����80�������¼��Ȳ���tʱ������Һ�еμ�������FeCl3��Һ���ⶨ��Һ�и��ɷֵ�Ũ����ͼ2��ʾ��H+Ũ��δ��������ͼ������X�Ļ�ѧʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������ȡҺ���Լ�����ȡ�����Լ������ܽ⣬�����ˣ���������һ��Ҫ�õ�����������
A. �٢ڢ� B. �ڢۢ� C. �٢ڢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A.��������ɵ�����һ���ǽ���������
B.Na2SO4��Һ�ڵ����������µ����Na+��SO42-������
C.������ˮ��Һ�е������������ȫ���������ӣ���������������
D.��������ͨ��Һ̬�Ȼ��⣬�����Ȼ��ⲻ�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£��ڴ�����ͬ�����������ݻ���ȵļס�����������ֱ���ж��������Ϳ������ֱַ������������ʵ�飺��N2O42NO2��H��0�� ��a�������������ڷ�ˮ�м���
��b���ڻ����϶���2kg������
������������£����������������С�ıȽϣ���ȷ���ǣ� ��
A.��a���ף��ң���b���ף���
B.��a���ף��ң���b����=��
C.��a���ף��ң���b���ף���
D.��a���ף��ң���b���ף���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����ԭ��һ������ͬһƽ����ǣ�������
A.��ϩ
B.��
C.����
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ͬ��ͬѹ�£�����ƿ�����ȵ�CO��CO2�������������������ķ�����Ŀ֮��Ϊ___��������ԭ������Ŀ֮��Ϊ___��������Ϊ___���ܶ�֮��Ϊ___��
(2)��Cu + 2H2SO4(Ũ) ![]() CuSO4+ SO2��+ 2H2O��Ӧ�У�
CuSO4+ SO2��+ 2H2O��Ӧ�У�
��______Ԫ�ر�������_______����������
����˫���ű���÷�Ӧ����ת�Ƶķ������Ŀ��
Cu + 2H2SO4(Ũ) ![]() CuSO4+ SO2��+ 2H2O
CuSO4+ SO2��+ 2H2O
������2.4mol��H2SO4���뷴Ӧ����ԭ��H2SO4Ϊ___g�����ɱ���µĶ�����������_______ L��ת�Ƶ��ӵ���ĿΪ_______________��(NA��ʾ�����ӵ�������ֵ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н��з�Ӧ��X��g��+3Y��g��2Z��g�����й�����ͼ���˵����ȷ���ǣ� ��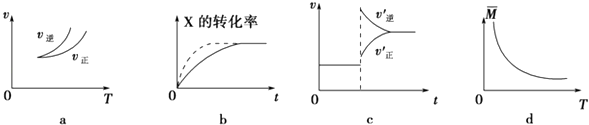
A.����ͼa���ж�����ӦΪ���ȷ�Ӧ
B.��ͼb�У����߿ɱ�ʾѹǿ����
C.������Ӧ�ġ�H��0��ͼc�ɱ�ʾ�����¶�ʹƽ�����淴Ӧ�����ƶ�
D.��ͼd������ƽ����Է����������¶ȵı仯���������֪����Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com