
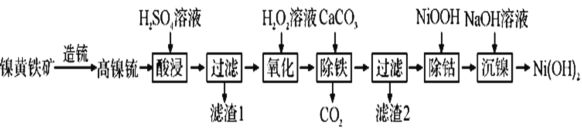
【题目】以镍黄铁矿为原料制备![]() 的工艺流程如下:
的工艺流程如下:
已知:①高镍锍的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() 的低价硫化物及合金;
的低价硫化物及合金;
②氧化性:![]() ;
;
③![]() ,
, ![]() ,
,![]() 。
。
回答下列问题:
(1)“酸浸”时,H2SO4溶液需过量,其目的是________。
(2)“过滤”时滤渣1的主要成分是________。
(3)“氧化”时反应的化学方程式为_________,若用NaClO代替H2O2溶液,使0.2molFe2+转化为Fe3+,则需NaClO至少为___mol。
(4)“除铁”的原理是_________。
(5)“除钴”时,发生反应的离子方程式为____________。
(6)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是_____。若“沉镍”后的滤液中![]() ,则滤液的pH>____
,则滤液的pH>____
【答案】提高镍元素的浸取率 Cu,Cu2S ![]() 0.1 调pH,使
0.1 调pH,使![]() 解生成
解生成![]() 沉淀而除去
沉淀而除去 ![]() 取最后一次洗涤液少量,向其中滴加盐酸酸化的
取最后一次洗涤液少量,向其中滴加盐酸酸化的![]() 溶液,若无白色沉淀生成,则沉淀已洗涤干净 9
溶液,若无白色沉淀生成,则沉淀已洗涤干净 9
【解析】
高镍锍的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() 的低价硫化物及合金,加硫酸溶液酸浸,过滤得滤渣1的主要成分为Cu,Cu2S;滤液中主要成分为NiSO4、FeSO4、CoSO4,加双氧水氧化,Fe2+转化为Fe3+,加CaCO3促进铁离子水解生成氢氧化铁沉淀,过滤,滤渣2的主要成分是
的低价硫化物及合金,加硫酸溶液酸浸,过滤得滤渣1的主要成分为Cu,Cu2S;滤液中主要成分为NiSO4、FeSO4、CoSO4,加双氧水氧化,Fe2+转化为Fe3+,加CaCO3促进铁离子水解生成氢氧化铁沉淀,过滤,滤渣2的主要成分是![]() 沉淀,滤液加NiOOH“除钴”时,发生反应的离子方程式为
沉淀,滤液加NiOOH“除钴”时,发生反应的离子方程式为![]() ,最后加NaOH溶液,“沉镍”后需过滤、洗涤、干燥得产品。
,最后加NaOH溶液,“沉镍”后需过滤、洗涤、干燥得产品。
(1)“酸浸”时,H2SO4溶液需过量,其目的是提高镍元素的浸取率。故答案为:提高镍元素的浸取率;
(2)Cu,Cu2S不溶于硫酸,“过滤”时滤渣1的主要成分是Cu,Cu2S。故答案为:Cu,Cu2S;
(3)双氧水将Fe2+转化为Fe3+,“氧化”时反应的化学方程式为![]() ,若用NaClO代替H2O2溶液,使0.2molFe2+转化为Fe3+,根据电子守恒,则需NaClO至少为
,若用NaClO代替H2O2溶液,使0.2molFe2+转化为Fe3+,根据电子守恒,则需NaClO至少为![]() =0.1mol。故答案为:
=0.1mol。故答案为:![]() ;0.1;
;0.1;
(4)Fe3++3H2O![]() Fe(OH)3+3H+,加入CaCO3与氢离子反应,使水解平衡正向移动,“除铁”的原理是调pH,使
Fe(OH)3+3H+,加入CaCO3与氢离子反应,使水解平衡正向移动,“除铁”的原理是调pH,使![]() 解生成
解生成![]() 沉淀而除去。故答案为:调pH,使
沉淀而除去。故答案为:调pH,使![]() 解生成
解生成![]() 沉淀而除去;
沉淀而除去;
(5)NiOOH“除钴”时,将Co2+氧化为Co3+形成氢氧化钴沉淀而除去,用发生反应的离子方程式为![]() 。故答案为:
。故答案为:![]() ;
;
(6)“沉镍”后需过滤、洗涤,固体表面上可能有硫酸根离子,证明沉淀已洗涤干净的方法是取最后一次洗涤液少量,向其中滴加盐酸酸化的![]() 溶液,若无白色沉淀生成,则沉淀已洗涤干净。若“沉镍”后的滤液中
溶液,若无白色沉淀生成,则沉淀已洗涤干净。若“沉镍”后的滤液中![]() ,
,![]() =c(Ni2+)c2(OH-),c(OH-)=
=c(Ni2+)c2(OH-),c(OH-)=![]() mol·L-1 =10-5mol·L-1 ,则滤液的pH>9;故答案为:取最后一次洗涤液少量,向其中滴加盐酸酸化的
mol·L-1 =10-5mol·L-1 ,则滤液的pH>9;故答案为:取最后一次洗涤液少量,向其中滴加盐酸酸化的![]() 溶液,若无白色沉淀生成,则沉淀已洗涤干净;9。
溶液,若无白色沉淀生成,则沉淀已洗涤干净;9。


科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.2kJmol-1,并于10分钟时达平衡。测得0到10秒内,c(H2)减小了0.75molL-1,下列说法正确的是
2NH3(g) ΔH=-92.2kJmol-1,并于10分钟时达平衡。测得0到10秒内,c(H2)减小了0.75molL-1,下列说法正确的是
A.10到15秒内c(NH3)增加量等于0.25molL-1
B.10秒内氨气的平均反应速率为0.025molL-1·s-1
C.达平衡后,分离出少量NH3,v正增大
D.该反应的逆反应的活化能不小于92.2kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是( )
A.熬胆矾(CuSO4·5H2O)铁釜,久之亦化为铜B.千淘万漉虽辛苦,吹尽狂沙始到金
C.凡石灰(CaCO3)经火焚炼为用D.丹砂(HgS)烧之成水银,积变又成丹砂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇![]() 的氧化锆
的氧化锆![]() 晶体,在熔融状态下能传导
晶体,在熔融状态下能传导![]() 。对该燃料的说法正确的是( )
。对该燃料的说法正确的是( )
A.在熔融电解质中,![]() 由负极移向正极
由负极移向正极
B.电池的总反应是:2C4H10+13O2![]() 8CO2+10H2O
8CO2+10H2O
C.通入空气的一极是正极,电极反应为:![]()
D.通入丁烷的一极是正极,电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的结构简式 看,苯分子中含有碳碳双键,应属于烯烃
看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是 ( )
A.常温常压下,17g甲基(-14CH3)所含的中子数为8NA
B.电解精炼铜,当外电路通过NA个电子时;阳极质量减少32g
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.17g H2O2中含有非极性键的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
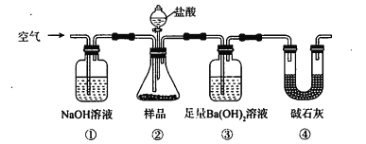
下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80 ℃时,在2 L密闭容器中充入0.40 mol N2O4,发生反应N2O4(g) ![]() 2NO2(g) ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
2NO2(g) ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
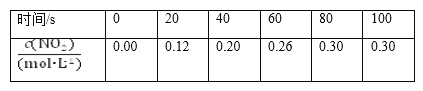
下列判断正确的是( )。
A.升高温度该反应的平衡常数K减小
B.20~40 s内,v(N2O4)=0.004 mol·L-1·s-1
C.反应达平衡时,吸收的热量为0.30Q kJ
D.100 s时再通入0.40 mol N2O4,达到新平衡时N2O4的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com