
分析 无色澄清溶液不含有Fe3+,
①用pH试纸检验,该溶液呈强酸性,说明含有H+,则不含有CO32-、HCO3-;
②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色,说明含有I-;
③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,则不含SO42-,以此解答该题.
解答 解:无色澄清溶液不含有Fe3+,
①用pH试纸检验,该溶液呈强酸性,说明含有H+,则不含有CO32-、HCO3-;
②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色,说明含有I-;
③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,则不含SO42-,
不能确定是否含有Na+,
(1)由以上分析可知一定含有H+、Ba2+、I-,一定没有Fe3+、SO42-、CO32-、HCO3-,可能含有Na+,
故答案为:H+、Ba2+、I-;Fe3+、SO42-、CO32-、HCO3-;Na+;
(2)若步骤②中消耗0.02molCl2,发生Cl2+2I-=2Cl-+I2,则n(I-)=0.04mol,c(I-)=$\frac{0.04mol}{0.2L}$=0.2mol/L,
故答案为:0.2mol/L;
(3)实验③中生成白色沉淀的离子方程式为Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查了常见的离子检验方法,题目难度中等,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
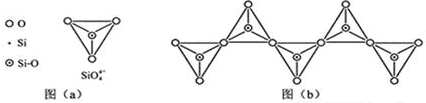
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
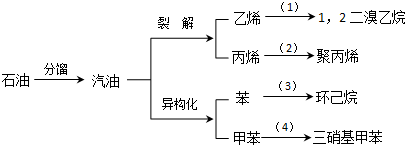
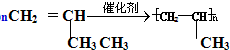 (加成聚合反应)
(加成聚合反应)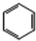 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$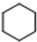 (加成反应)
(加成反应)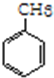 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$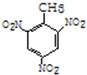 +3H2O(取代反应)
+3H2O(取代反应)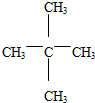 .
. .
.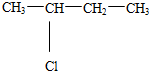 (不考虑顺反异构).
(不考虑顺反异构).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| C. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO${\;}_{3}^{2-}$═CaCO3↓+SO${\;}_{3}^{2-}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO${\;}_{3}^{-}$═3Ag++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com