
| 操 作 | 现 象 |
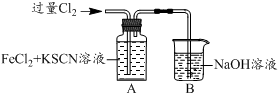 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
 .
.分析 (1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,据此答题;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,据此答题;
(4)①根据SCN-的电子式为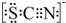 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,据此答题;
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,据此答题;
②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素,据此答题;
③利用硝酸根离子在酸性条件下有强氧化性,遇到铜被还原,生成一氧化氮,在空气中被 氧化成红棕色的二氧化氮气体,可以检验硝酸根离子的存在,据此答题;
④SCN-与Cl2反应的化学方程式可以计算出电子转移的物质的量.
解答 解:(1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)氯气具有强氧化性,则Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,
故答案为:Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,
故答案为:Fe3+;
(4)①根据SCN-的电子式为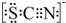 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,
故答案为:SCN-中的碳元素是最高价态+4价;
②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素,
故答案为:硫元素;
③利用硝酸根离子在酸性条件下有强氧化性,遇到铜被还原,生成一氧化氮,在空气中被 氧化成红棕色的二氧化氮气体,可以检验硝酸根离子的存在,据此可知实验方案为:取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成NO3-,
故答案为:取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成NO3-;
④SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,该反应中电子转移数目为16,则由方程式可知,每生成1mol二氧化碳要转移16mol电子,
故答案为:16.
点评 本题是实验方案的设计与评价,题目难度中等,试题综合性较强,涉及到了离子的检验、氧化还原的离子方程式的书写、实验步骤的设计、化学计算等知识点,熟练掌握元素化合物的基础知识及实验基本操作要求为解答关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 铵盐受热易分解,实验室常加热硝酸铵与氢氧化钙的混合物制取氨气 | |
| C. | 氯化铁有氧化性,工业上用FeCl3溶液蚀刻铜箔制造电路板 | |
| D. | 氨水具有弱碱性,可与饱和氯化铁溶液反应制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 升高温度该反应的平衡常数K减小 | |
| B. | 20~40 s 内,v(N2O4)=0.004 mol•L-1•s1 | |
| C. | 反应达平衡时,吸收的热量为0.30 Q kJ | |
| D. | 100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,等物质的量的乙烯(C2H4)和CO所含的分子数目相等 | |
| B. | 等物质的量的N2和CO在标准状况下的体积均为22.4L | |
| C. | 同温同压下,等体积的物质所含分子数目一定相等 | |
| D. | 1molHCl中所含的分子数目和1L1mol/L盐酸中所含的分子数目相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com