
分析 根据方程式知,该反应中Fe失电子发生氧化反应,则Fe作负极,不如Fe活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐作电解质,据此分析解答.
解答 解:根据方程式知,该反应中Fe失电子发生氧化反应,则Fe作负极,不如Fe活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐作电解质,正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,
故答案为:Fe;2Fe3++2e-=2Fe2+.
点评 本题考查原电池设计,为高频考点,明确原电池原理是解本题关键,明确元素化合价变化与正负极关系是解本题关键,会根据电池反应式确定正负极材料和电解质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | A原子最外层外层电子数比B原子最外层外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的氢气比1molB从酸中置换生成的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
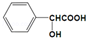
 +NaOH→
+NaOH→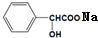 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
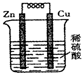
| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 铜片上有气泡产生 | D. | 电子由铜片经导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将宽度0.2~0.3cm的铝条在酒精灯火焰上灼烧片刻,可观察到铝条马上剧烈燃烧 | |
| B. | 为了培养大颗粒的明矾晶体,配制90℃的饱和溶液后骤冷 | |
| C. | 做乙醇170℃时的脱水实验制取乙烯时,为使烧瓶受热均匀,温度慢慢上升到170℃ | |
| D. | 为了检验某工业废水中的酚类物质是否存在,用三氯化铁溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,反应中Cl得到电子 | |
| B. | 当1 mol Cl2完全反应时,有2 mol电子发生转移 | |
| C. | NaBr是还原剂,反应中Br-得到电子 | |
| D. | 当1 mol NaBr完全反应时,有1 mol电子发生转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com