
分析 (1)固体粒子之间的相互作用力很大,把粒子紧扣在一起,所以粒子只能在固定的位置上振动;
(2)含有自由移动离子或电子的物质能导电;在熔融状态下或水溶液里能导电的化合物是电解质;
(3)在水溶液里和熔融状态下都不导电的化合物是非电解质;
(4)根据n=$\frac{V}{V{\;}_{m}}$计算混合气体的总的物质的量,设CO的物质的量为x,CO2的物质的量为y,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算CO2的体积分数.
解答 解:(1)组成物质的微粒之间存在相互作用,各微粒之间既有相互吸引力,又有相互排斥力,当微粒距离较近时,排斥力的作用明显,将微粒推开,当微粒距离较大时,吸引力的作用明显,将微粒拉近,所以通常微粒在较平衡的位置上做极小的运动,即只能在各自平衡位置附近做微小振动,故选:①②;
(2)②铜中含有自由的电子,所以能导电,但属于单质既不是电解质也不是非电解质;③KNO3溶液含有自由的离子,所以能导电,但属于混合物既不是电解质也不是非电解质;④熔融的氢氧化钾中含有自由移动的离子,所以能导电,也属于电解质;故选:④;
(3)⑦干冰虽然在水溶液中能导电,但不是自身电离,则为非电解质; ⑧酒精在水溶液里或熔融状态下都以分子存在,所以是非电解质,故选:⑦⑧;
(4)标准状况下,混合气体的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,
设CO的物质的量为x,CO2的物质的量为y,则:$\left\{\begin{array}{l}{x+y=0.3}\\{28x+44y=12}\end{array}\right.$
解得:x=0.075mol,y=0.225mol,
此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3;
CO2的体积分数是=$\frac{0.225mol}{0.3mol}$×100%=75%;
故答案为:1:3; 75%.
点评 本题考查电解质和非电解质的判断、能导电的物质以及混合物计算、物质的量有关计算,难度不大,注意对公式的理解与灵活应用.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
 (1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1 2B+C.
2B+C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可以加快反应速率 | |
| B. | 增大压强可以加快反应速率 | |
| C. | 反应达到平衡时,v(正)=v(逆) | |
| D. | 增大O2的量可以使NH3100%转变为NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
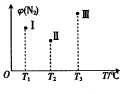 分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )
分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )| A. | 在t min时,Ⅱ和Ⅲ一定达平衡状态 | |
| B. | 2v(NH3)=3v(H2)时,三个容器均达平衡状态 | |
| C. | 平衡后容器Ⅰ中混合气体的平均相对分子质量最小 | |
| D. | 已知tmin时,Ⅲ中c(N2)=1mol/L,此时反应平衡常数K=0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
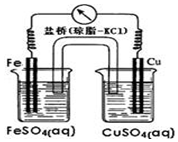
| A. | 铜作正极,发生氧化反应 | |
| B. | 外电路中电流方向为Fe→Cu | |
| C. | Fe电极的电极反应式为Fe-3e-=Fe3+ | |
| D. | 盐桥将两电解质溶液连接起来,传导电流,通过等量的K+和Cl-的定向移动,使两电解质溶液保持电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com