
| B | ||
| A | C |
分析 根据A、B、C三种元素在周期表中的位置可知,B位于第二周期,A、C位于第三周期,设B的核外电子总数为x,B的核电荷数=质子数=x,B元素的原子核内质子数等于中子数,则B的质量数为2x;则A的核外电子数=原子序数=x+8-1,C的最外层电子数为x+8+1,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,则:x+(x+8-1)+(x+8+1)=2.5×2x,解得:x=8,则B为O元素、A为P元素、C为Cl元素,然后联系元素周期表、元素周期律知识对各选项进行判断.
解答 解:根据图示及元素周期表结构可知,B位于第二周期,A、C位于第三周期,设B的核外电子总数为x,B的核电荷数=质子数=x,B元素的原子核内质子数等于中子数,则B的质量数为2x;则A的核外电子数=原子序数=x+8-1,C的最外层电子数为x+8+1,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,则:x+(x+8-1)+(x+8+1)=2.5×2x,解得:x=8,则B为O元素、A为P元素、C为Cl元素,
(1)由以上分析可知,A为P元素,B为O元素,C为Cl元素,
故答案为:P、O、Cl;
(2)B为O元素,位于周期表中第二周期第ⅥA族,
故答案为:二,ⅥA;
(3)C为Cl元素,C的气态氢化物的化学式为HCl,其水溶液呈酸性,
故答案为:酸.
点评 本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意元素所对应的化合物的结构和性质,注重基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时的电离平衡曲线如下图所示:
已知水在25℃和95℃时的电离平衡曲线如下图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
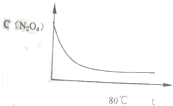 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
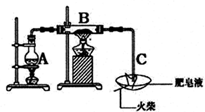 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).| 实验步骤 | 预期实验现象与结论 |
| 取反应后干燥的固体于试管中,加入足量的1mol•L-1硫酸溶解 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 将1 L0.5mol/L的浓盐酸加热浓缩为0.5L | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100 mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
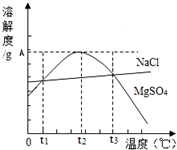
| A. | 只有在t1℃时,NaCl和MgSO4的溶解度才相等 | |
| B. | t1℃~t2℃,MgSO4的溶解度随温度升高而减小 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:X2R>X2Y | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z位于第三周期第ⅢA族,Z与Y形成的化合物是一种比较好的耐火材料 | |
| D. | 使甲基橙变红色的溶液中:K+、R2-、ZY2-、WY32- 一定能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若图象为Ⅰ,则m+n>p+q | |
| B. | 若图象为Ⅱ,则m+n=p+q,t2时刻改变的条件一定是使用催化剂 | |
| C. | 若图象为Ⅲ,则该可逆反应的△H<0 | |
| D. | 若图象为Ⅳ,且压强p1>压强p2,则该可逆反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com