
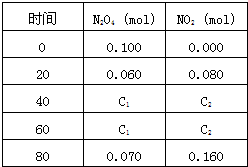
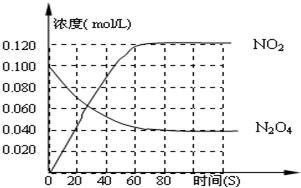
在一体积为1L的容器中,通入一定量的N2O4
,在100℃时发生如下反应,N2O4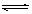 2NO2–Q(Q>0),其N2O4 和NO2 浓度变化如图如示。
2NO2–Q(Q>0),其N2O4 和NO2 浓度变化如图如示。

(1) 上述反应的平衡常数表达式为______________,升高温度K值_______(填“增大”、“减小”或“不变”)
(2) 在0-60s这段时间内,四氧化二氮的平均反应速率为________mol/L.s
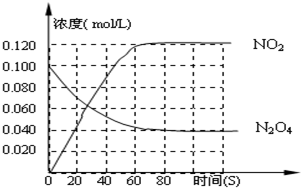
(3)120℃时,在相同的容器中发生上述反应,容器内各物质的物质的量变化如图:
 |
①该温度时,反应处于平衡状态的时间是____________,C1的数值_____0.04(填“大于”、“小于”或“等于”。
②反应在60-80s间平衡向逆反应方向移动,可能的原因是( )
(A) 使用催化剂 (B) 减少N2O4的浓度
(C)减小体系压强 (D) 增加NO2的浓度
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
 在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应,N2O4
在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应,N2O4  2NO2-Q(Q>0),其N2O4 和NO2 浓度变化如图如示.
2NO2-Q(Q>0),其N2O4 和NO2 浓度变化如图如示.| [c(NO2)]2 |
| c(N2O4) |
| [c(NO2)]2 |
| c(N2O4) |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:2009年上海市浦东新区南汇中学高考化学模拟试卷(解析版) 题型:解答题
 2NO2-Q(Q>0),其N2O4 和NO2 浓度变化如图如示.
2NO2-Q(Q>0),其N2O4 和NO2 浓度变化如图如示.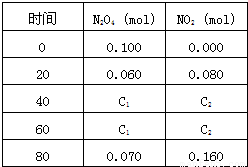
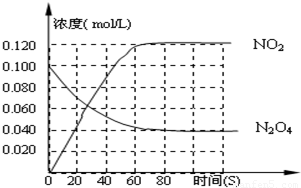
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积为1L的容器中,通入一定量的N2O4 ,在100℃时发生如下反应:
N2O4 ![]() 2NO2 Q(Q>0),其N2O4 和NO2 浓度变化如图如示。
2NO2 Q(Q>0),其N2O4 和NO2 浓度变化如图如示。
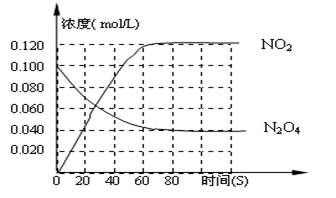
(1)上述反应的平衡常数表达式为______________,升高温度K值_______(填“增大”、“减小”或“不变”)]
(2) 在0-60s这段时间内,四氧化二氮的平均反应速率为________mol/L.s
(3)120℃时,在相同的容器中发生上述反应,容器内各物质的物质的量变化如图
|
① 该温度时,反应处于平衡状态的时间是 ,C1的数值 0.04(填“大于”、“小于”或“等于”)。
② 反应在60-80s间平衡向逆反应方向移动,可能的原因是( )
(A) 使用催化剂 (B) 减少N2O4的浓度
(C) 减小体系压强 (D) 增加NO2的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com