
| A. |  | B. | 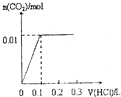 | C. | 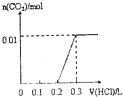 | D. |  |
分析 对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
解答 解:4gNaOH的物质的量为0.1mol和0.1mol Na2CO3混合并配成溶液,首先和NaOH反应生成水和氯化钠,当滴入到第一个格时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入到第二个格时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,正好与图象C相符,故选C.
点评 此题考查了元素化合物、图象数据的处理知识,解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量碳酸钙固体放在广口瓶中 | |
| B. | 少量浓硝酸放在棕色细口瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成白色沉淀、有气体产生 | B. | 生成红褐色沉淀、有气体产生 | ||
| C. | 生成红褐色沉淀 | D. | 生成黑色沉淀、有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.75 mol/L | B. | 1.5 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 |
| 物质 | MnS | CoS | NiS |
| Ksp | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
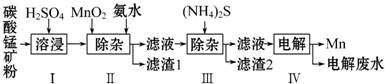
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求完成下列小题.
按要求完成下列小题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的物质的量浓度减小 | D. | C的体积分数降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com