
【题目】完成下列有关反应的化学方程式,并注明有关反应条件:
(1)2-溴丙烷消去反应方程式________________________________;
(2)1,3-丁二烯的加聚反应方程式____________________________;
(3)CH3CH2CHO与新制Cu(OH)2反应的方程式_________________;
【答案】 CH3CHBrCH3+NaOH ![]() CH3CH=CH2↑+NaBr+H2O CH2=CH-CH=CH2
CH3CH=CH2↑+NaBr+H2O CH2=CH-CH=CH2 ![]() [CH2-CH=CH-CH2]n CH3CH2CHO + 2Cu(OH)2
[CH2-CH=CH-CH2]n CH3CH2CHO + 2Cu(OH)2![]() CH2CH2COOH+Cu2O+2H2O
CH2CH2COOH+Cu2O+2H2O
【解析】本题考查有机化学方程式的书写。(1)2-溴丙烷在NaOH的醇溶液中加热发生消去反应生成丙烯,其反应方程式为:CH3CHBrCH3+NaOH ![]() CH3CH=CH2↑+NaBr+H2O;(2)1,3-丁二烯的加聚反应原理为两个碳碳双键断开,在其中间两个碳原子之间形成新的双键,其反应方程式为:nCH2=CH-CH=CH2
CH3CH=CH2↑+NaBr+H2O;(2)1,3-丁二烯的加聚反应原理为两个碳碳双键断开,在其中间两个碳原子之间形成新的双键,其反应方程式为:nCH2=CH-CH=CH2![]()
![]() ;(3)CH3CH2CHO被新制Cu(OH)2氧化为乙酸,其反应的方程式为:CH3CH2CHO + NaOH+2Cu(OH)2
;(3)CH3CH2CHO被新制Cu(OH)2氧化为乙酸,其反应的方程式为:CH3CH2CHO + NaOH+2Cu(OH)2![]()
![]() CH2CH2COONa+Cu2O↓+3H2O。
CH2CH2COONa+Cu2O↓+3H2O。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置进行相应的实验,不能达到实验目的的是( )
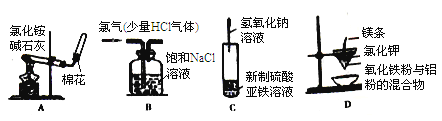
A.实验室制取并收集氨气 B.除去Cl2中的HCl气体杂质
C.实验室制取氢氧化亚铁 D.铝热反应实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe与稀HNO3反应时,若两者消耗物质的量之比为4∶10,且生成 Fe(NO3)2,则反应中生成的还原产物可能是( )
A.N2B.N2OC.NOD.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
① CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③ H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____________。
(2)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图所示,则阴极的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+ 4C(s)![]() 3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1
3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1
②C(s)+ CO2(g)![]() 2CO(g) △H=+172.5kJ·mol﹣1
2CO(g) △H=+172.5kJ·mol﹣1
则Fe3O4(s)+ 4CO(g)![]() 3Fe(s)+ 4CO2(g) △H=________________.
3Fe(s)+ 4CO2(g) △H=________________.
(2)反应Fe(s)+ CO2(g)![]() FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:
温度/K | 973 | 1173 | 1373 | 1573 |
K | 1.47 | 2.15 | 3.36 | 8.92 |
①从表中数据可推断,该反应是___________(填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是_____________(填字母).
A.c(CO2)= c(CO) B.v正(CO2)= v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+ CO2(g)![]() CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:

①图2中,若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=____mol·L﹣1·min ﹣1。
②图1中t2时刻改变的条件是________________________________(任写两种,下同);图2中t2时刻改变的条件是_________________________________.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl﹣)= ![]() c(Na+)=c(SO
c(Na+)=c(SO ![]() ),则其溶质可能是( )
),则其溶质可能是( )
A.KCl、Na2SO4
B.KCl、Na2SO4、NaCl
C.NaCl、K2SO4
D.KCl、K2SO4、Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 84消毒液
[有效成分]NaClO
[规格]1000mL
[质量分数]25%
[密度]1.19gcm﹣3
(1)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为g;所用到的玻璃仪器有玻璃棒、烧杯、量筒和 .
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm﹣3)的浓硫酸配制2000mL2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力. ①所配制的稀硫酸中,H+的物质的量浓度为molL﹣1 .
②需用浓硫酸的体积为mL.
(4)配置一定物质的量浓度的稀硫酸时,下列操作会使所配溶液物质的量浓度偏低的是 .
A.定容时俯视容量瓶刻度线
B.用量筒量取浓硫酸时俯视刻度线
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线.
E.加水时超过刻度线,用胶头滴管吸出.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com