
| A. | 该反应为还原反应 | |
| B. | 上述反应中若产生0.1mol SO42-,则消耗SO2的物质的量为0.1mol | |
| C. | Fe2(SO4)3、品红两种溶液都能使上述反应进行 | |
| D. | 通入Cl2会增强SO2的漂白作用 |
分析 A.变化过程中有元素化合价的变化,硫元素化合价升高被氧化发生氧化反应;
B.依据SO2-2e-+2H2O→SO42-+4H+反应计算;
C.三价铁离子具有氧化性,能氧化二氧化硫,品红和二氧化硫结合为无色物质,没有发生氧化还原反应;
D.氯气和二氧化硫1:1反应生成硫酸和盐酸.
解答 解:A.依据反应SO2-2e-+2H2O→SO42-+4H+,二氧化硫失去电子发生氧化反应,故A错误;
B.依据SO2-2e-+2H2O→SO42-+4H+反应计算,产生0.1 molSO42-,则消耗SO2的物质的量为0.1mol,故B正确;
C.Fe2(SO4)3具有氧化性能氧化二氧化硫使反应进行,品红会结合二氧化硫形成不稳定的无色物质不能使氧化反应进行,故C错误;
D.氯气和二氧化硫反应,SO2+Cl2+2H2O=H2SO4+2HCl,所以通入Cl2会降低SO2的漂白作用,故D错误;
故选B.
点评 本题考查了氧化还原反应的概念应用,为高频考点,侧重于学生的分析能力的考查,题目主要考查二氧化硫化学性质的应用和判断,关键是化合价的变化判断,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
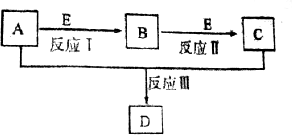
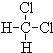 和
和 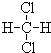
 与
与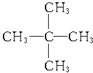
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2OH | B. | (CH3)2COHCH2CH3 | ||
| C. | (CH3)2CHCH2CH2OH | D. | (CH3)3CCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
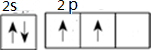
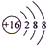 .A+、C2-、D-中离子半径最小的是Na+.
.A+、C2-、D-中离子半径最小的是Na+.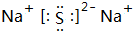 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
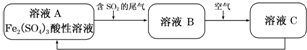
| A. | 向B溶液中滴加KSCN溶液,溶液不会变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+Ba (OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | C (s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1 | |
| D. | C (s,石墨)+$\frac{1}{2}$O2(g)═CO (g)△H=-393.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
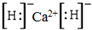 .
.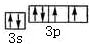 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com