
【题目】氯和碘是ⅦA元素,回答下列问题:
(1)I3-中心原子的价层电子对数为_______ ,沸点ICl____Cl2(填大于,小于,等于)。
(2)已知CsICl2受热分解,该分解的化学方程式是___________________。
(3)已知高碘酸的结构如图1所示,1mol高碘酸中含有__________mol![]() 键。
键。
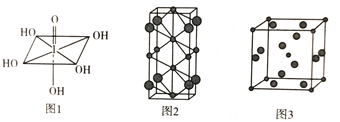
(4)Na和Cl两种元素可以形成不同类型的晶体,如图2和图3(大球为氯原子,小球为钠原子),图2化学式为_____________;图3中Na+的配位数为___________。
(5)若图3晶胞的边长为a cm,则晶体的密度![]() =____(NA表示阿伏加德罗常数的值)。
=____(NA表示阿伏加德罗常数的值)。
【答案】5 大于 CsICl2 ![]() CsCl + ICl 11 Na2Cl 12
CsCl + ICl 11 Na2Cl 12 ![]() gcm-3
gcm-3
【解析】
根据中心原子的价层电子对数计算公式计算,根据晶体类型及微粒间作用力比较熔沸点;根据物质的稳定性及原子守恒分析反应产物书写反应方程式;根据物质结构图及成键方式计算σ键数目;根据晶胞的结构计算晶胞密度并书写化学式。
(1)中心原子的价层电子对数(注意可不是价电子数)=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数,I3-根据价层电子对互斥理论计算出孤电子对数为3,成键电子对数为2,因此价层电子对数为5;ICl和Cl2属于分析晶体,组成和结构相似,相对分子质量越大,分子间作用力越强,则沸点越高,则沸点ICl大于Cl2,故答案为:5;大于;
(2)由于CsCl的晶格能大于CsI,更稳定,因此产物CsCl 和 ICl,反应方程式为:CsICl2 ![]() CsCl + Icl,故答案为:CsICl2
CsCl + Icl,故答案为:CsICl2 ![]() CsCl + ICl;
CsCl + ICl;
(3)单键为σ键,双键中有1个σ键,所以根据高碘酸的结构可知1 mol高碘酸中含有11 mol σ键,故答案为:11;
(4)图2中Na+个数为2+2×1/2+4×1/4=4,Cl-个数为8×1/4=2,故化学式为Na2Cl; Na+的配位数即为与Na+紧邻的Cl-数,图3中与Na+位于体心,Cl-位于每个面的面上,一共有6个面,每个面有两个,所以与Na+紧邻的Cl-共12个,故答案为:Na2Cl;12;
(5)图3晶胞中含有钠离子数目为:8×1/8+1=2,氯离子数目为:2×1/2×6=6,则晶胞的质量为:![]() ,晶胞的边长为a cm,则体积为a3 cm3,所以晶胞的密度
,晶胞的边长为a cm,则体积为a3 cm3,所以晶胞的密度![]() =
=![]() gcm-3,故答案为:
gcm-3,故答案为: ![]() gcm-3。
gcm-3。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】运用元素周期律分析下面的推断,其中错误的是![]()
A.铍![]() 的氧化物对应的水化物可能具有两性
的氧化物对应的水化物可能具有两性
B.砹![]() 为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
C.硒化氢![]() 是无色、有毒且稳定性比硫化氢还差的气体
是无色、有毒且稳定性比硫化氢还差的气体
D.同一主族的元素从上到下,金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C分别是三种有机物的结构模型:
A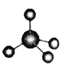 B
B C
C
请回答下列问题:
(1)上述三种模型最能真实体现有机物空间构型的是_____(填序号)。
(2)B及其同系物的分子式符合通式____(用n表示)。当n=_____时,烯烃开始出现同分异构体。
(3)有机物C中,共直线的的原子有_______个。
(4)有机物C具有的结构或性质是______(填字母序号)。
a .是碳碳双键和碳碳单键交替的结构 b. 有毒、不溶于水、密度比水小
c. 不能使酸性KMnO4溶液和溴水褪色 d. 一定条件下能与氢气或氧气反应
(5)等物质的量的A、B、C三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是_____(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
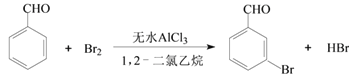
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
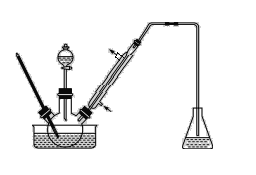
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g) + B(g)xC(g) + 2D(g),经4min后,测得D的浓度为0.4mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1 mol·(L ·min) -1。下列说法错误的是
A.A在4min末的浓度是0.6mol/LB.B在4min内的平均反应速率0.05 mol.L -1·min -1
C.x值是1D.起始时物质A的浓度为2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________(填“正向”或“逆向”)进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com