
| A. | KOH | B. | Na2CO3 | C. | HClO4 | D. | NaHSO4 |
分析 常温下,水的离子积为1×10-14,由水电离产生的c(H+)等于10-10mol/L,说明该溶液中的溶质抑制了水的电离,该溶液为酸性或者碱性溶液,据此进行判断.
解答 解:由水电离产生的c(H+)等于10-10mol/L,说明溶液中的溶质抑制了水的电离,
KOH、HClO4、NaHSO4都能电离出氢氧根离子或氢离子,抑制水的电离;而Na2CO3电离出的碳酸根离子结合水电离的氢离子,促进了水的电离,水的电离程度增大,故该溶液的溶质不可能是Na2CO3,故选B.
点评 本题考查水的电离及其影响因素,难度不大.注意酸碱溶液抑制水的电离,含有弱酸根或弱碱根离子的盐溶液促进水的电离.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:多选题
| A. | NH4Cl固体为离子化合物 | |
| B. | CO2分子中含有离子健 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | X2+的核外有18个电子,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
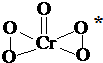 氧元素与多种元素具有亲和力,所形成化合物的种类很多.
氧元素与多种元素具有亲和力,所形成化合物的种类很多.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和乙烯 | B. | 乙醇和丙醇 | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中阴离子物质的量基本不变 | |
| B. | 正极的电极反应式是:O2+4H++4e-═2H2O | |
| C. | 正极的电极反应式是:N2H4+4OH--4e═4H2O+N2↑ | |
| D. | 溶液中阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3CCH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CHCH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2与NO2 | B. | CO2与N2O | C. | SO2与O2 | D. | PCl3与BF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点样后应在滤纸上形成一个直径较大的样斑,便于实验时观察 | |
| B. | 展开剂可以既是流动相又是固定相 | |
| C. | 为使层析实验有较好的分离效果,试样溶液浓度应较小 | |
| D. | 纸层析法简称纸层析,是色谱分析法的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2$\frac{\underline{\;500℃\;}}{V_{2}O_{5}}$2SO3△H=-196.6 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com