
| A. | ①②③④ | B. | ②③④ | C. | 只有③④ | D. | 只有④ |
分析 同温同压下等体积CO2和CO的物质的量相等,则含有分子数目相等,每份均含有1个C原子,故含有碳原子数目相等,根据m=nM可知,二者质量不相等,同温同压下气体的密度之比等于其相对分子质量之比.
解答 解:同温同压下等体积CO2和CO的物质的量相等.
①根据m=nM可知,二者质量之比为44g/mol:28g/mol=11:7,二者质量不相等,故①错误;
②同温同压下气体的密度之比等于其相对分子质量之比,二者密度之比为44g:28g=11:7,二者密度不相等,故②错误;
③二者物质的量相等,根据N=nNA可知,所含分子数相等,故③正确;
④含有分子数目相等,每份均含有1个C原子,故含有碳原子数目相等,故④正确,
故选:C.
点评 本题考查阿伏伽德罗定律及其推论,难度不大,注意对公式的理解与灵活应用,注意根据PV=nRT理解阿伏伽德罗定律及其推论.


科目:高中化学 来源: 题型:选择题
| A. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| B. | 某物质中含有离子键,则该物质在任何条件下均可导电 | |
| C. | 干冰是分子晶体,其气化过程中只需克服分子间作用力 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
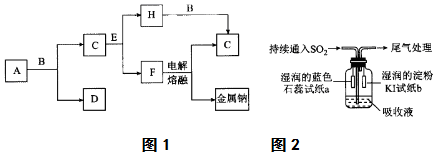
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液一定显酸性 | B. | 溶液一定显碱性 | ||
| C. | 溶液一定不显中性 | D. | 溶液可能显酸性.也可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
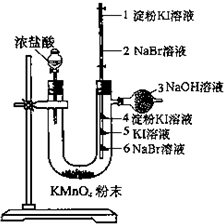 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com