
【题目】等电子体具有相似的化学特征。下列物质中与CO2结构相似的是( )
A.N2OB.SiO2C.MgCl2D.COCl2
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组制备消毒液(主要成分是NaClO),设计了下列装置。
已知:Cl2和NaOH溶液能发生下列反应
在加热时:![]()
在低温时:![]()
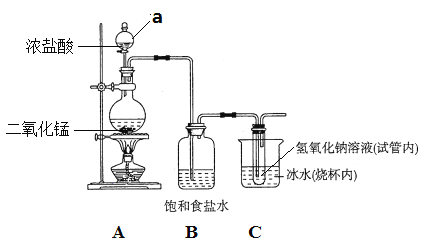
试回答下列问题:
⑴仪器a的名称是_____________。
⑵连接好装置,装药品之前,必须进行的一项操作是_________________。
⑶A装置内发生反应的化学方程式为_______________________________。
⑷B的作用是___________;冰水的作用是__________________________。
⑸该装置的不足之处有___________________________________________。
⑹一定温度下,向NaOH溶液中通入一定量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
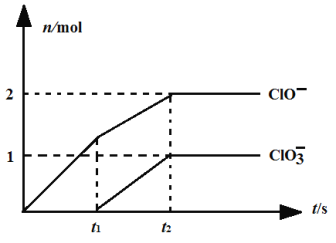
该过程中t2时刻参加反应的Cl2物质的量为_________mol;若另一过程产生的n(Cl-)为5.5mol,n(ClO3-)为1mol,则参加反应的NaOH物质的量为___________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅢA族的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)基态Ga原子价电子排布图为________.
(2)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___;与NO2+互为等电子体的微粒有_____(写出一种)。
(3)铵盐大多不稳定,NH4F、NH4I中,较易分解的是_____,原因是______.
(4)第二周期中,第一电离能介于B元素和N元素之间的元素有______种。
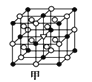
(5)晶体别有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见下图),每个顶点为一个硼原子,每个三角形均为等边三角形。若此结构单元为1个分子,则其分子式为____.

(6)冰晶石(Na3AlF6)由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,ο位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是_________ (填微粒符号)。
(7)A1单质的晶体中原子的堆积方式如图乙所示,其晶跑特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若己知Al的原子半径为dnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目_____个;Al晶体的密度为_____g/cm3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某物质的量浓度的AlCl3溶液中滴入2 mol·L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
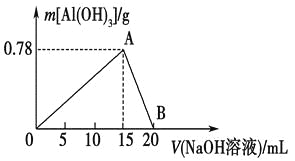
(1)图中A点表示的意义是_________________________。
(2)图中B点表示的意义是_________________________。
(3)上述两步反应用总的离子方程式可表示为:____________________________。
(4)若所得Al(OH)3沉淀0.39 g,则此时用去NaOH溶液的体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示装置中加入一定量的铁粉,分液漏斗中加入一定体积浓度为12 mol·L-1的硝酸,加热打开分液漏斗的活塞,使其充分反应后,
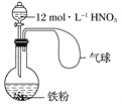
下列微粒:①![]() 、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
A.①B.①⑤C.②④⑤D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )
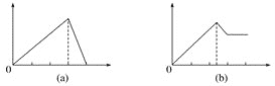
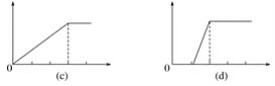
A.①-(d)B.②-(b)C.③-(c)D.④-(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3:1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
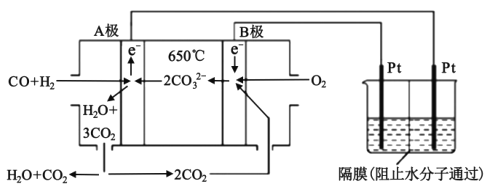
(1)H2(g)、CO(g)的燃烧热△H分别为-285.8kJmol-1、-283.0kJmol-1,18g液态水变为水蒸气时吸热44.0kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的△H=___kJmol-1,B电极上发生反应的电极反应式为___。
(2)若以此电源生产新型硝化剂N2O5,装置如图所示。已知两室加入的试剂分别是a.硝酸溶液;b.N2O4+无水硝酸,则左室加入的试剂应为___(填“a”或“b”),其电极反应式为___。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___L。电解后溶液体积为500mL,溶液的pH约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
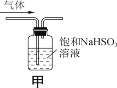
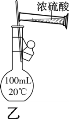
A.可用干燥的pH试纸测量氯水的pH
B.蒸干FeCl3溶液制无水FeCl3固体
C.用装置甲除去SO2中的少量HCl
D.用装置乙配制100 mL 0.50 mol·L-1硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
C(s)+![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com