
(18分) A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1) G的基态原子的外围电子排布式为_____________________________________,在周期表中属于________区。
(2) B与F形成的一种非极性分子的电子式为_________________________;F的一种具有强还原性的氧化物分子的VSEPR模型为___________。
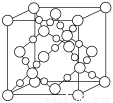
(3) BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。
(4) 设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液
③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为________________。
(5) 丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6) A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:____________________。
(7) 往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是__。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO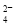 与PO
与PO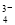 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
(1)3d104s1 ds (2) 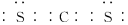 平面三角形 (3)原子 (4)1∶1∶108
平面三角形 (3)原子 (4)1∶1∶108
(5)c(Na+)>c(SO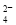 )>c(Al3+)>c(H+)>c(OH-)
)>c(Al3+)>c(H+)>c(OH-)
(6)NH2Cl+H2O===HClO+NH3 (7)AD
【解析】
试题分析:A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等,原子核外电子排布为1s22s22p2,则B为碳元素;D原子p轨道上成对电子数等于未成对电子数,外围电子排布为ns2np4,处于ⅥA族,F最高正价与最低负价的代数和为4,最外层电子数为6,故D为氧元素、F为硫元素;C元素原子最外层p能级比s能级多1个电子,外围电子排布为ns2np3,处于ⅤA族,原子序数小于氧元素,故C为氮元素;E的常见化合价为+3,原子序数大于氧元素小于硫元素,故E为Al; G+的M层电子全充满,则G原子的核外电子=2+8+18+1=29,故G为Cu元素。
(1)G为Cu,基态原子的外围电子排布式为3d104s1,周期表中属于ds区。
(2)C元素与S元素形成的一种非极性分子为CS2,电子式为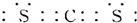 ;S元素的一种具有强还原性的氧化物为SO2,分子中S原子价层电子对数=6÷2=3,该分子VSEPR模型为平面三角形。
;S元素的一种具有强还原性的氧化物为SO2,分子中S原子价层电子对数=6÷2=3,该分子VSEPR模型为平面三角形。
(3)由CO2在高温高压下所形成的晶胞可知,C原子与掌握4个O原子形成4个C-O键,而O原子与周围2个C原子形成2个C-O键,形成立体网状结构,属于原子晶体。
(4)甲为氨气,乙为硝酸,丙为硝酸铵,常温下,①pH=11的氨水中氢离子为水电离产生,故水电离出的c(H+)=10-11mol/L,②pH=3的硝酸的水溶液中水电离产生的氢离子等于溶液中氢氧根离子浓度,故水电离出的c(H+)=10-11mol/L,③pH=3的硝酸铵溶液中氢离子为水电离产生,故水电离出的c(H+)=10-3mol/L,则3种溶液中水电离出的c(H+)之比=10-11mol/L:10-11mol/L:10-3mol/L=1:1:108。
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应,则丁为NaAlO2、丙为NaHSO4,当丁、戊溶液以物质的量之比为1:4混合后,发生反应:2NaAlO2+8NaHSO4=Al2(SO4)3+5Na2SO4+4H2O,溶液中铝离子水解,溶液呈酸性,钠离子浓度最大,硫酸根浓度大于铝离子,故溶液中各离子浓度大小顺序为:c(Na+)>c(SO42-)>c(Al3+)>c(H+)>c(OH-)。
(6)氯化物NH2Cl可作杀菌剂,其原理为NH2Cl遇水反应生成一种具有强氧化性的含氧酸,应生成HClO,还生成NH3,NH2Cl与水反应的化学方程式为NH2Cl+H2O═HClO+NH3。
(7)往硫酸铜溶液中加入过量氨水,可生成一种配合物X为[Cu(NH3)4]SO4,A、[Cu(NH3)4]SO4中所含化学键有离子键、极性键和配位键,正确;B、[Cu(NH3)4]SO4中Cu2+提供空轨道,NH3给出孤对电子,错误;C、[Cu(NH3)4]SO4的元素中第一电离能最大的是氮元素,错误;D、SO42-中S原子价层电子对数=(6+2)÷2=4,没有孤电子对,故SO42-为正四面体结构,SO42-与PO43-互为等电子体,PO43-也正四面体结构,正确。
考点:本题考查元素推断、核外电子排布、分子结构、溶液pH相关计算、离子浓度比较、配合物。


科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A、加入一种反应物 B、升高温度
C、对平衡体系增加压强 D、使用催化剂
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g) 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+ CO(g)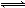 MgO(s)+CO2(g)+SO2(g) ΔH>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
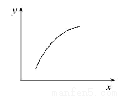
选项 | X | Y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
下列有关能量的判断或表示方法正确的是
A.从C(石墨)=C(金刚石) ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH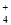 )> c(SO
)> c(SO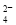 )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO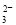 )+c(HCO
)+c(HCO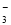 )+c(OH-)
)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO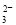 )
)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
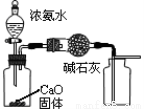
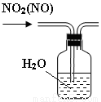
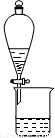
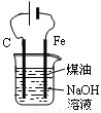
图1 图2 图3 图4
A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是()
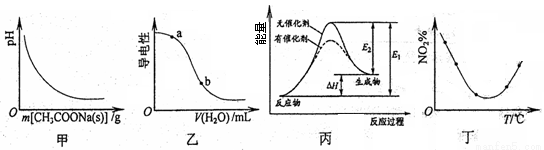
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
(16分)某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
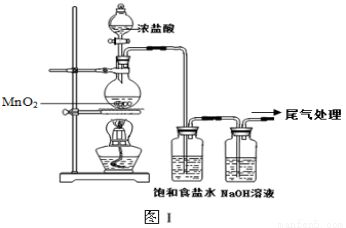
 实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
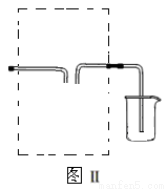
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
ⅰ.NaClO把Na2SO3氧化了 ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 (填序号)。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com