
【题目】没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。其结构简式如图所示。
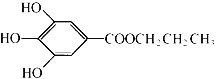
已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2
回答下列问题:
(1)从分子结构或性质上看,PG具有抗氧化作用的主要原因是:______(文字简述)
(2)1mol没食子酸最多可以与含________mol碳酸钠的溶液发生反应。
(3)写出PG在NaOH溶液中水解的化学方程式:_______________________。
(4)没食子酸有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:____。
a.含有苯环,且苯环上的一溴代物只有一种;
b.既能发生银镜反应,又能发生水解反应。
【答案】含有酚羟基 4 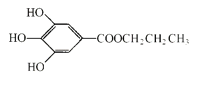 +4NaOH
+4NaOH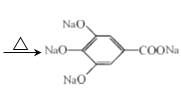 +CH3CH2CH2OH+3H2O
+CH3CH2CH2OH+3H2O 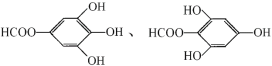
【解析】
PG分子中含有酚羟基,可发生取代、氧化和显色反应,含有酯基,在一定条件下可发生取代反应,没食子酸含3个酚-OH和1个-COOH,以此解答该题。
(1)分子中含有酚羟基,易被氧化,在食用油中起抗氧化作用;
(2)没食子酸含3个酚OH和1个COOH,均能与碳酸钠反应,则1mol没食子酸最多可以与含4mol碳酸钠的溶液发生反应;
(3)PG分子中含有3个酚羟基,可与氢氧化钠发生中和反应,含有酯基,可水解生成羧基和醇,则与氢氧化钠反应的方程式为 +4NaOH
+4NaOH +CH3CH2CH2OH+3H2O;
+CH3CH2CH2OH+3H2O;
(4)a.含有苯环,且苯环上的一溴代物只有一种,说明结构对称;
b.既能发生银镜反应,又能发生水解反应,说明分子中含有甲酸酯,则对应的结构简式为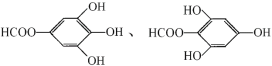 。
。


科目:高中化学 来源: 题型:
【题目】如图所示:
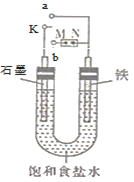
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________极(填“正”或“负”),电解池总反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解 NaHSO4 溶液制备 Na2S2O8(其中阴离子结构为![]() )。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
)。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
A.SO42-向阳极迁移
B.阳极可换为铜电极
C.阳极反应中 S 的化合价不变
D.阴极电极反应式:2H++2e-=H2↑。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸为一元弱酸,在15mL0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线。下面有关微粒浓度的大小关系正确的是
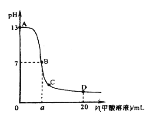
A. 在A、B间的任意一点上都存在:c(K+)>c(HCOO-)>c(OH-)>c(H+)
B. 在B点:c(K+)= c(HCOO-)>c(OH-)=c(H+),且a=7.5
C. 在C点:c(HCOO-)>c(K+)>c(H+)>c(OH-)
D. 在D点: c(HCOO-)+ c(HCOOH)=2 c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.使pH试纸显深蓝色的溶液:Ca2+、NH4+、HCO3-、Cl-
B.室温下,![]() =0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
C.含FeCl3的溶液:K+、Na+、SO42-、CO32-
D.能与金属铝反应放出氢气的溶液:Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素(结构如图中I所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。

已知:CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)香豆素分子中的官能团的名称为__,步骤Ⅱ→Ⅲ的反应类型为__。
(2)有机物III的结构简式为__,在上述转化过程中,设计反应步骤II→III的目的是__。
(3)下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是__(选填序号)。
A.可用FeCl3溶液来鉴别II和III
B.Ⅳ中核磁共振氢谱共有4种峰
C.Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色
D.1molⅡ最多能和2molNaHCO3发生反应
(4)香豆素在过量NaOH溶液中完全水解的化学方程式为__。
(5)写出乙二酸和乙二醇(HOCH2CH2OH)生成Ⅴ的化学方程式为__。
(6)化合物Ⅳ有多种同分异构体,符合下列两个条件的芳香族同分异构体共有__种。
①遇FeCl3溶液发生显色反应;
②能发生水解反应和银镜反应。
其中,核磁共振氢谱共有5种吸收峰,且吸收峰面积比为1∶2∶2∶2∶1同分异构体的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO
A.①②③B.②③④C.①③⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,稀强酸与稀强碱溶液反应中和热为57.3kJ/mol。
(1)写出表示稀H2SO4与稀烧碱溶液反应的中和热的热化学方程式:___。
(2)学生甲用50mL0.25mol/L硫酸与50mL0.55mol/L烧碱溶液测定中和热装置如图。
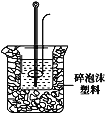
①实验时所需的玻璃仪器除烧杯、量筒外还需:__。
②该装置中有一处错误是:___。如果用该错误装置测定,测得的中和热ΔH会___(填“偏大、偏小、无影响”)。
③如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热___(填“相等、不相等”)。
④若反应前溶液以及中和后的混合液的密度均设为1g/cm3,混合前酸与碱的温度均为t1,混合后溶液的温度为t2,比热容为4.18J/(g·℃),则中和热ΔH=___。
(3)学生乙用2mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图装置:
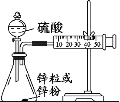
该生两次实验测定时间均设定为10min,则他还要测定的另一个数据是:___。
②若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入___(填字母)
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
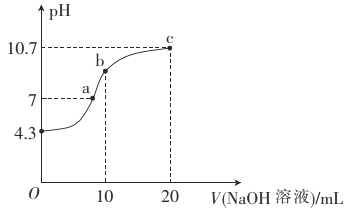
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com