
| ||
| ||


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
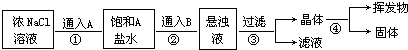
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1Na2SO3 溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于非金属性B>D,则A、B组成化合物的沸点高于A、D组成的化合物 |
| B、在C、B形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C、原子半径由大到小排列的是:C>D>E>B>A |
| D、B、C、E三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②③④⑤ |
| C、②③④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、铝粉溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
| C、在酸性的硫酸亚铁溶液中加入双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O |
| D、硫化氢气体通入氯化铁溶液中:Fe3++H2S=Fe2++S↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com