(2009?盐城一模)氯化铁是常见的水处理剂,无水FeCl
3的熔点为555K、沸点为588K.工业上处理无水FeCl
3的一种工艺如图所示:
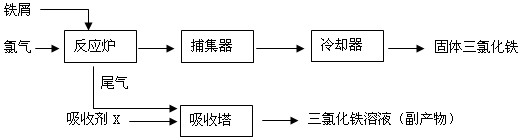
(1)取0.5ml三氯化铁溶液滴入50ml沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为:
.
(2)表中是六水合氯化铁在水中的溶解度.
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度/g |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl
3溶液中获得FeCl
3?6H
2O的方法是:
加入少量盐酸加热浓缩,再冷却结晶
加入少量盐酸加热浓缩,再冷却结晶
.
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:
Fe2Cl6
Fe2Cl6
.
(4)室温时在FeCl
3溶液中滴加NaOH溶液,当溶液PH为2.7时,Fe
3+开始沉淀;当溶液PH为4时,c(Fe
3+)=
1.1×10-6
1.1×10-6
mol/L(已知:Ksp[Fe(OH)
3]=1.1×10
-36).
(5)吸收剂X是
FeCl2溶液
FeCl2溶液
;吸收塔中吸收剂X的作用是
吸收反应炉中过量的氯气和少量氯化铁烟气
吸收反应炉中过量的氯气和少量氯化铁烟气
.
(6)FeCl
3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100ml容量瓶,用蒸馏水定容;取出10.00ml,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na
2S
2O
3溶液滴定(I
2+2S
2O
32-═2I
-+S
4O
62-),共用去V ml.则样品中氯化铁的质量分数为
.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案