


科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是二氧化硫 | D.反应中硫酸作氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
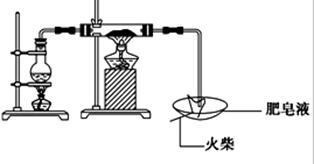
| | 实验步骤 | 预期现象与结论 |
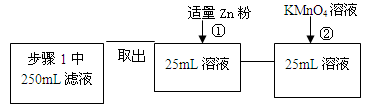
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.制备碱式硫酸铁利用了过氧化氢的氧化性 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.③⑤ | B.②⑤ | C.①②④ | D.①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com