
把A、B、C、D四块金属泡在稀硫酸中,用导线两两相连可以组成各种原电池,若A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活泼性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D
C.A>C>D>B D.B>D>C>A
科目:高中化学 来源:2014-2015学年山西省校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.化学反应只生成新物质,没有能量的变化
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二上学期期中化学试卷(解析版) 题型:选择题
下列元素中,基态原子的最外层电子排布式不正确的是
A.As 4s24p3 B.Cr 3d44s2 C.Ar 3s23p6 D.Ni 3d84s2
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次质量检测化学试卷(解析版) 题型:选择题
下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.氢氧燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次质量检测化学试卷(解析版) 题型:选择题
在298K、100kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2 (g)=2HCl(g) ΔH2
2Cl2(g)+2 H2O (g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考理综化学试卷(解析版) 题型:填空题
(14分)高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体。
(1)从以上元素中选择,在自然界中有游离态存在的有 元素(填元素符号)。
(2)离子交换膜是一类具有离子交换功能的高分子材料。一容器被离子交换膜分成左右两部分,如图所示。

若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后可观察到的现象:右边 (从下列选项中选择)
A.无明显现象 B.溶液由浅绿色变红色
C.溶液由无色变黄色 D.溶液由浅绿色变无色
左边发生反应的离子方程式: ;
若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 。
(3)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用。通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b。(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。)
①若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为 。
②若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有____________;
然后向滤液中继续加适量乙酸乙酯并加热可得沉淀,写出生成沉淀的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考理综化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3ˉ+2OHˉ=CaCO3↓+CO32ˉ+2H2O
B.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3ˉ+2OH- NH3↑+SO32ˉ+2H2O
NH3↑+SO32ˉ+2H2O
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性: H++SO42ˉ+Ba2++OHˉ=BaSO4↓+H2O
D.向KIO3与KI混合溶液中加入醋酸发生反应生成I2:IO3ˉ+5Iˉ+6H+=3I2+3H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邢台市高三上学期第四次月考化学试卷(解析版) 题型:选择题
用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是
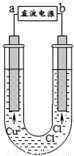
A.通电使CuC12发生电离
B.a端是直流电源的负极
C.阳极上发生的反应:Cu2++2e- == Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高三上学期期中考试化学试卷(解析版) 题型:选择题
2SO2(g) + O2(g) 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量(mol) | n(SO2) | 0.4 | 0.8 | 0.8 |
n(O2) | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com