
| A. | 用明矾作净水剂 | B. | 用硫磺粉处理散落在地上的汞 | ||
| C. | 用食醋清洗水壶中的水垢 | D. | 服用复方氢氧化铝片治疗胃酸过多 |
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为△H=-285.5k•Jmol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ•mol-1 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 相同条件下,在两个相同的恒容密闭容器中,1molN2和3molH2反应放出的热量与2molN2和3molH2反应放出的热量一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在徐料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在徐料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素及其化合物在生产、生活中有广泛应用.请回答下列问题:
元素及其化合物在生产、生活中有广泛应用.请回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
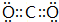 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3molC+1molD | B. | 2molA+1molB+3molC+1molD | ||
| C. | 3molC+1molD+1molB | D. | 4molA+2molB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 五氧化二碘可用于消除CO的污染,也可定量测定CO含量,其反应原理为
五氧化二碘可用于消除CO的污染,也可定量测定CO含量,其反应原理为查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c<d | B. | 0.5a>b | ||
| C. | 氢气的燃烧热为akj/mol | D. | 一氧化碳的燃烧热为(d-c)kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如图曲线I所示.
800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如图曲线I所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com