
| A、保持温度一定,向该浊液中加入适量的生石灰,溶液pH>13 |
| B、保持温度一定,向该浊液中加入适量的生石灰,溶液Ca2+数目减小 |
| C、向浊液中加入适量的Na2CO3或NH4Cl溶液,都会使溶液变得澄清 |
| D、将浊液加热蒸发掉一部分水,或加入pH=12的烧碱溶液,都能使浊液中固体的质量增大 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
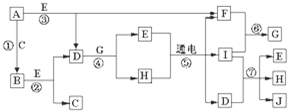
 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酸式滴定管量取25.00mL溴水 |
| B、不宜用瓷坩埚熔融氢氧化钠或碳酸钠 |
| C、测定溶液的pH时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D、圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、NO3-、MnO4- |
| B、K +、SO42-、OH-、CO32- |
| C、K +、Fe3+、Cl-、Br- |
| D、Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| B、25℃时,pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
| C、用惰性电极电解NaOH、H2SO4、Ba(OH)2中任意一种的溶液时只生成氢气和氧气 |
| D、在水电离出的H+浓度为1×10-12 mol/L的溶液中,K+、NO3-、I-一定能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 373 | 473 | 573 | 673 | 773 |
| K | 3.35×109 | 1.00×107 | 2.45×105 | 1.88×104 | 2.99×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、纯铝制品在空气中表面逐渐失去金属光泽 |
| C、锌与稀硫酸反应时,往溶液中滴入几滴CuSO4溶液可以使反应变快 |
| D、与电源的负极相连的金属不易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0LPH=1的H2SO4溶液中所含H+数为0.2 NA |
B、26g (聚乙炔)所含碳碳双键数为2 NA (聚乙炔)所含碳碳双键数为2 NA |
| C、1moAl13-团簇离子的最外层电子总数为40 NA |
| D、标准状况下,22.4LCO、CO2混合气体中所含碳原子数为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com