
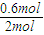 ×100%=30%,故答案为:30%;
×100%=30%,故答案为:30%;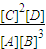 =
=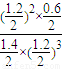 =
= ,故答案为:
,故答案为: .
.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| 5 |
| 7 |
| 5 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
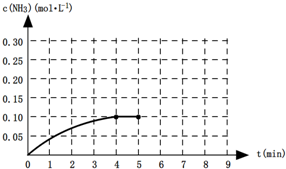
(10分)在一密闭体系中发生下列反应:N2(g)+3H2(g) 2NH3(g);△H<0 。
回答下列问题:
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为____________________,用H2浓度变化表示的平均
反应速率为__ ____ ,该温度下的平衡常数K= ____________。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 ___________________ 。
(3)右图是某一时间段速率-时间曲线图。
若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 _____
(“正移”“逆移”“不移动”)。
①请在图中画出t1→t2时间段反应速率变化情况。
②t3、t5时刻体系中所改变的某一条件分 别是:__________________________、_______________;其中表示平衡混合物中NH3的含量最高的时间段是___________.
查看答案和解析>>
科目:高中化学 来源:2010年浙江江山实验中学高二年级5月月考化学试卷 题型:实验题
已知:向一体积为2L的密闭容器中加入0.1mol碘单质和足量的钨,当温度为943K时 存在:W(s)+I2(g)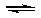 WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
(1)求943K时此反应的平衡常 数:K=_____________
(2)若起始时向此密闭容器中再加入0.1mol WI2 达平衡,此时容器中各气体的体积 比:___________,当同时加入等物质的量I2(g) 和WI2(g),平衡___________方向移动(填正反 应、逆反应或不移动)
⑶画出W(s) + I2(g) 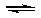 WI2(g) △H<0时 间—速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
WI2(g) △H<0时 间—速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
(4)一定温度下,向一容积不变的容器中加入足量钨和1molI2(g),使之反应: W(s) + I2(g) 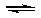 WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
查看答案和解析>>
科目:高中化学 来源:2013届江西省高二上学期期末考试化学试卷 题型:填空题
(10分)在一密闭体系中发生下列反应:N2(g)+3H2(g)  2NH3(g);△H<0 。
2NH3(g);△H<0 。
回答下列问题:
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为____________________,用H2浓度变化表示的平均
反应速率为__ ____ ,该温度下的平衡常数K= ____________。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 ___________________ 。
(3)右图是某一时间段速率-时间曲线图。
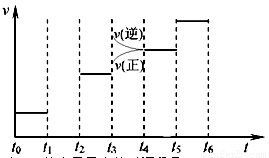
若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 _____
(“正移”“逆移”“不移动”)。
①请在图中画出t1→t2时间段反应速率变化情况。
②t3、t5时刻体系中所改变的某一条件分 别是:__________________________、_______________;其中表示平衡混合物中NH3的含量最高的时间段是___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com