
| A. | 在地壳中的含量:Al>Fe>Na | |
| B. | 均能与盐酸反应,生成物中金属价态数值:Al>Fe>Na | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁 | |
| D. | 少量金属钠保存在煤油里 |
分析 A.在地壳中元素含量大小顺序是O、Si、Al、Fe、Ca…;
B.Al、Fe、Na都可以与稀盐酸反应,且这三种元素在氯化物中化合价依次是+3、+2、+1;
C.钠性质较活泼,将钠投入盐溶液中,钠先和水反应;
D.钠极易和氧气、水反应而变质,所以钠贮存时要隔绝空气和水.
解答 解:A.在地壳中元素含量大小顺序是O、Si、Al、Fe、Ca…,所以在地壳中的含量:Al>Fe>Na,故A正确;
B.Al、Fe、Na都可以与稀盐酸反应,且这三种元素在氯化物中化合价依次是+3、+2、+1,所以生成物中金属价态数值:Al>Fe>Na,故B正确;
C.钠性质较活泼,将钠投入盐溶液中,钠先和水反应,所以将Na投入FeCl3溶液中,钠先和水反应生成NaOH,生成的NaOH再和氯化铁发生复分解反应生成氢氧化铁,所以得不到铁单质,故C错误;
D.钠极易和氧气、水反应而变质,所以钠贮存时要隔绝空气和水,煤油不和钠反应,且密度小于钠,所以少量金属钠保存在煤油里,故D正确;
故选C.
点评 本题考查钠的性质、钠的贮存等知识点,为高频考点,明确性质是解本题关键,易错选项是C,注意:在任何水溶液中钠都先和水反应,题目难度不大.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙二醇 | B. | 丙醇、丁醇 | C. | 丙醇、丙烯 | D. | 丁醇、乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的酯化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | C8H10含苯环的烃的同分异构体有3种 | |
| C. | 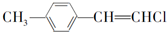 分子中的所有原子不可能共平面 分子中的所有原子不可能共平面 | |
| D. | 莽草酸(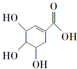 )能与溴水发生取代反应而褪色 )能与溴水发生取代反应而褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漂白粉可以净化饮用水 | |
| B. | 铜的金属性比铁弱,所以可用铜罐代替铁罐贮藏浓硝酸 | |
| C. | 合成纤维和光导纤维都是人工合成的有机高分子化合物 | |
| D. | 工业上可用石灰乳对煤燃烧形成的烟气进行脱硫,最终能制得石膏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
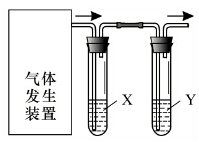 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( ) | 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
| B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
| C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.533L | B. | 0.267L | C. | 4.0L | D. | 2.0L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com