
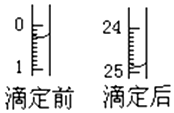
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.分析 (1)根据滴定管的结构以及测量体积的原理可知消耗标准液的体积等于滴后体积减去滴前体积;
(2)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)滴定前读数为:0.30mL,滴定后读数为:24.90mL,消耗溶液的体积为24.60mL,
故答案为:24.60;
(2)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差:
a.若滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标准)无影响,可知c(待测)无影响,故答案为:无影响;
b.读数时,若滴定前仰视,滴定后俯视,造成V(标准)偏小,可知c(待测)偏低,故答案为:偏低.
点评 本题考查了中和滴定时的读数及误差分析,要求掌握滴定管的结构和中和滴定的实验原理,试题难易适中,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-、ClO-、Na+、H+ | B. | Cl-、NH4+、NO3-、H+ | ||
| C. | K+、Cu2+、Cl-、SO42- | D. | OH-、Mg2+、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次实验平衡时反应放出的热量为294.9kJ | |
| B. | 两次实验平衡时,SO2的转化率相等 | |
| C. | 第二次实验达平衡时SO3的体积分数大于$\frac{2}{9}$ | |
| D. | 达平衡时,O2表示的反应速率为0.25mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
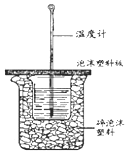 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com