
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
 .
. 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
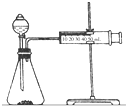 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρ}{800}$mol•L-1 | B. | 1.25ρmol•L-1 | C. | $\frac{ρ}{1600}$mol•L-1 | D. | 0.63mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
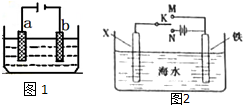 电化学原理在工业生产中有重要应用.如图1所示电解池中:
电化学原理在工业生产中有重要应用.如图1所示电解池中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终酸性高锰酸钾溶液褪色 | B. | 反应中甲醛被还原 | ||
| C. | 最终酸性高锰酸钾溶液是红色 | D. | 说明甲醛是具有氧化性的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 |
| 元素符号 | ①Na | ②Cl |
| 原子结构 示意图 |  | ③  |
| 周期 | 三 | 三 |
| 族 | ④IA | VII A |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物肯定是酸性氧化物 | |
| B. | 碱性氧化物肯定是金属氧化物 | |
| C. | 金属氧化物都是碱性氧化物 | |
| D. | 不能跟酸反应的氧化物一定能跟碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中若混有乙烯,可通过酸性高锰酸钾溶液除去 | |
| B. | 乙醇中是否混有水,可用加入金属钠是否产生气体进行检验 | |
| C. | 蚕丝和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | AB线表示Al3+的物质的量的变化 | B. | OC表示AlO2-的物质的量的变化 | ||
| C. | CD线表示Al(OH)3的物质的量的变化 | D. | BE线表示AlO2-的物质的量的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com