
【题目】Ca(NO2)2常用作钢筋混凝土工程中的阻锈剂。硝酸工业尾气中含有大量氮氧化物,含较多NO的尾气可用于制取Ca(NO2)2,工业流程如下:
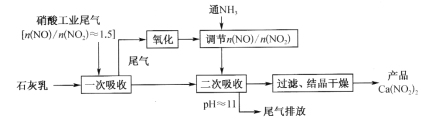
已知:Ca(OH)2 + NO + NO2![]() Ca(NO2)2 + H2O;
Ca(NO2)2 + H2O;
2Ca(OH)2 + 4NO2![]() Ca(NO2)2 + Ca(NO3)2 + 2H2O
Ca(NO2)2 + Ca(NO3)2 + 2H2O
回答下列问题:
(1)Ca(NO2)2的名称是____________。
(2)一次吸收后的尾气通过浓硝酸,一部分NO被浓硝酸氧化,反应的化学方程式是____;
在一定条件下,通入NH3将过多的NO2还原为N2以调节n(NO)/n(NO2)的比值,反应中氧化剂与还原剂的物质的量之比为___。
(3)在整个过程中,控制n(NO)/n(NO2)>1的目的是_______________。
(4)用石灰乳两次吸收的目的是_______。
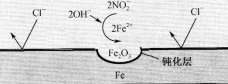
(5)在钢筋混凝土中,Ca(NO2)2可阻止Cl-对钢筋的腐蚀,其原理如下图示,该反应的离子方程式为____________。
(6)产品中主要含有的杂质是Ca(NO3)2。测定Ca(NO3)2含量的实验步骤是:称取0.410g产品溶于水,加入过量Na2SO4溶液,过滤,在滤液中加入足量NH4Cl饱和溶液(发生反应:NH4++NO2-![]() N2 + 2H2O);充分反应后,用稀硫酸酸化,向溶液中加入过量的15.00mL0.1000mol/L (NH4)2Fe(SO4)2溶液至充分反应(假设还原产物为NO);加入N-苯基邻氨基苯甲酸做指示剂,用0.1000mol/LK2Cr2O7标准溶液滴定剩余的Fe2+,消耗标准溶液2.00mL。则:产品中Ca(NO3)2的质量分数为________。
N2 + 2H2O);充分反应后,用稀硫酸酸化,向溶液中加入过量的15.00mL0.1000mol/L (NH4)2Fe(SO4)2溶液至充分反应(假设还原产物为NO);加入N-苯基邻氨基苯甲酸做指示剂,用0.1000mol/LK2Cr2O7标准溶液滴定剩余的Fe2+,消耗标准溶液2.00mL。则:产品中Ca(NO3)2的质量分数为________。
【答案】亚硝酸钙 NO + 2HNO3![]() 3NO2 + H2O 3:4 减小生成Ca(NO3)2的相对量 提高吸收液中Ca(NO2)2的浓度并减少排放尾气中的氮氧化物 2NO2- + 2Fe2+ + 2OH-
3NO2 + H2O 3:4 减小生成Ca(NO3)2的相对量 提高吸收液中Ca(NO2)2的浓度并减少排放尾气中的氮氧化物 2NO2- + 2Fe2+ + 2OH-![]() Fe2O3 + 2NO↑+ H2O 2.00%
Fe2O3 + 2NO↑+ H2O 2.00%
【解析】
(1)Ca(NO2)2中氮元素的化合价为+3价,其名称是亚硝酸钙;
(2)一次吸收后的尾气通过浓硝酸,一部分NO被浓硝酸氧化生成二氧化氮和水,反应的化学方程式是NO + 2HNO3![]() 3NO2 + H2O;
3NO2 + H2O;
NH3将过多的NO2还原为N2,同时生成水,反应的化学方程式为6NO+4NH3=5N2+6H2O,NO中氮元素化合价降低作氧化剂,NH3中氮元素化合价升高作还原剂,根据反应可知反应中氧化剂与还原剂的物质的量之比为3:4;
(3) 若n( NO):n( NO2)<l,则会发生副反应产生Ca(NO3)2,故在整个过程中,控制n(NO)/n(NO2)>1的目的是减小生成Ca(NO3)2的相对量;
(4)用石灰乳两次吸收,以提高吸收液中Ca(NO2)2的浓度并减少排放尾气中的氮氧化物;
(5)在钢筋混凝土中,Ca(NO2)2可阻止Cl-对钢筋的腐蚀,根据图示可知,碱性条件下亚硝酸根离子将亚铁离子氧化产生氧化膜氧化铁,形成钝化层,该反应的离子方程式为2NO2- + 2Fe2+ + 2OH-![]() Fe2O3 + 2NO↑+ H2O;
Fe2O3 + 2NO↑+ H2O;
(6) 15.00mL0.1000mol/L (NH4)2Fe(SO4)2溶液中n(Fe2+)=15.00×10-3L×0.1000mol/L=1.5×10-3mol,根据反应Cr2O72-+6 Fe2++ 14H+= 6Fe3++2Cr3++7H2O可知,用0.1000mol/LK2Cr2O7标准溶液滴定剩余的Fe2+的物质的是为2.00×10-3L×0.1000mol/L×6=1.2×10-3mol,故与硝酸根离子反应的亚铁离子的物质的量为3×10-4mol,根据反应NO3-+3Fe2++ 4H+= 3Fe3++NO↑+2H2O可知,n(NO3-)=3×10-4mol×![]() =1×10-4mol,则:产品中Ca(NO3)2的质量分数为
=1×10-4mol,则:产品中Ca(NO3)2的质量分数为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2010年8月至今年4月,浙江共查处酒后驾驶204596起,其中醉酒驾驶20593起,行政拘留20471人。案件起数,居全国前列。交警执法时,主要测量驾驶员体内的( )
A.醋酸B.乙醇C.甲醛D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是
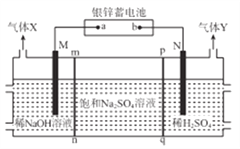
A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol气体X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述正确的是( )
①钠在空气中燃烧生成氧化钠
②金属钠可以保存在煤油中
③钠与硫酸铜溶液反应,可以置换出铜
④金属钠有强还原性
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
A.①②④B.②③⑤C.①④⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
(1)上述仪器中,在配制稀硫酸时不需要用到的是___________(填序号)
(2)配制过程中需选用的容量瓶规格为___________ mL,经过计算,需要浓硫酸的体积为_______。
(3)在配制过程中,下列操作错误的是____________,能使所配溶液浓度偏高的是___________(填序号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④移液前,容量瓶中含有少量蒸馏水
⑤量取浓硫酸时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
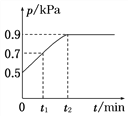
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解产物,某学生设计了如下实验方案:
淀粉液![]() 水解液
水解液![]() 混合液
混合液![]() 砖红色沉淀
砖红色沉淀
回答下列问题:
试剂2是_____________,作用是___________________;如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的______________,若不能,其原因是_________________,最简单的改正措施是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 往碳酸镁中滴加稀盐酸:CO![]() + 2H
+ 2H![]() = CO2↑+ H2O
= CO2↑+ H2O
B. 用小苏打治疗胃酸过多:HCO![]() + H
+ H![]() = CO2↑+ H2O
= CO2↑+ H2O
C. 盐酸滴入氨水中:H![]() + OH
+ OH![]() = H2O
= H2O
D. 锌溶解于稀硝酸中:Zn+ 2H![]() =Zn2++ H2↑
=Zn2++ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com