
 纸电池是一种有广泛应用的“软电池”,如图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰.下列有关该纸电池说法不合理的是( )
纸电池是一种有广泛应用的“软电池”,如图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰.下列有关该纸电池说法不合理的是( )| A. | Zn为负极,进行氧化反应 | |
| B. | 电池工作时,电子由MnO2流向Zn | |
| C. | 正极反应:MnO2+e-+H2O═MnO(OH)+OH- | |
| D. | 电池总反应:Zn+2MnO2+2H2O═Zn(OH)2+2MnO(OH) |
分析 碱性条件下,锌和二氧化锰构成原电池,其电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),所以Zn被氧化,为原电池的负极,电极反应为Zn-2e-+2OH-=ZnO+H2O,MnO2被还原,为原电池的正极,电极反应为MnO2+H2O+e-=MnO(OH)+OH-,以此来解答.
解答 解:A、锌作负极失去电子被氧化,发生氧化反应,故A正确;
B、电子由负极经外电路流向正极,即Zn流向MnO2,故B错误;
C、MnO2被还原,为原电池的正极,电极反应为MnO2+H2O+e-=MnO(OH)+OH-,故C正确;
D、碱性条件下,锌和二氧化锰构成原电池,其电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),故D正确.
故选B.
点评 本题考查化学电源新型电池,侧重于电极反应方程式的考查,题目难度中等,注意从正负极发生的变化结合电解质的特点书写电极反应式.


科目:高中化学 来源: 题型:解答题
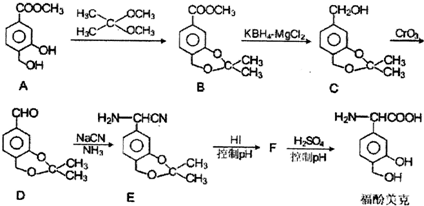
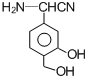 .
.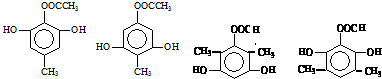 任意一种.
任意一种.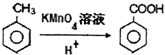 根据已有知识并结合相关信息,写出以
根据已有知识并结合相关信息,写出以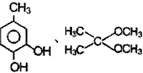 和C2H5OH为原料制备
和C2H5OH为原料制备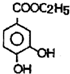 的合成路线流程图(无机试剂任用),合成路线流程图示例如图:
的合成路线流程图(无机试剂任用),合成路线流程图示例如图: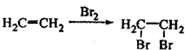
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皂化反应是指酯在碱性条件下的水解过程 | |
| B. | 硬水使肥皂的去污能力减弱是因为发生了沉淀反应 | |
| C. | 判断油脂皂化反应是否基本完成,可通过反应后的溶液能否使红色石蕊试纸变蓝色 | |
| D. | 使高级脂肪酸从皂化反应后的混合物中析出,可用氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| B. | 乙醇既能与有机化合物反应又能与无机化合物反应 | |
| C. | 煤焦油、石油、花生油都属于烃 | |
| D. | 鸡蛋清中加入饱和(NH4)2SO4溶液会使蛋白质失去生理活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,若有6mol电子发生转移,则有2mol K2FeO4被氧化 | |
| B. | 放电时,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH- | |
| C. | 充电时,电池的负极与外接电源的正极相连 | |
| D. | 充电时,阴极附近溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 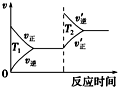 | B. | 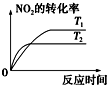 | C. | 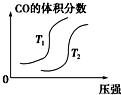 | D. | 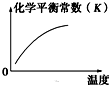 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
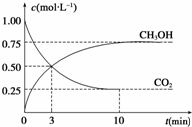 新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com