
如图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
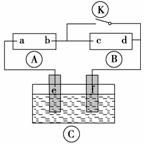
(1)电源A上的a为_________________________________________________极。
(2)滤纸B上发生的总化学反应方程式为___________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为
________________________________________________________________________,
电极f上发生的反应为______________________________________________,
槽中盛放的电镀液可以是__________或__________(只要求填两种电解质溶液)。
答案 (1)正
(2)2NaCl+2H2O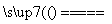 H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
(3)Zn—→Zn2++2e- Zn2++2e-—→Zn
ZnSO4溶液 ZnCl2溶液
解析 (1)解答本题的关键之处是:“B上的c点显红色”,c点之所以呈红色,是因为此处发生电极反应后为碱性,使酚酞变红色,故c点发生的反应是:2H++2e-—→H2↑,式中的H+来自水:H2OH++OH-,消耗了H+,过剩的OH-使酚酞显红色。c点发生还原反应,应为电解池的阴极,因此b为负极,a应为正极。
(2)滤纸(B)上发生的化学反应,实为电解NaCl溶液,故总化学反应方程式为:2NaCl+2H2O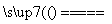 H2↑+Cl2↑+2NaOH。
H2↑+Cl2↑+2NaOH。
(3)铁上镀锌,镀层金属应为阳极,接电源的正极。因此镀槽(C)中,e应为金属锌(阳极),它发生阳极溶解,反应式为:Zn—→Zn2++2e-;而f应为镀件(金属铁),在它上面发生的反应是:Zn2++2e-—→Zn(沉积于铁阴极上);镀液应含Zn2+,ZnSO4和ZnCl2是合理的选择,当然不限于这两种。


科目:高中化学 来源: 题型:
某烃1 mol最多能和2 mol HCl加成,生成氯代烃,此氯代烃l mol能和6 mol Cl2发生取代反应,生成物中只有碳氯两种元素,此烃为( )
A.C2H2 B.C2H4 C.C3H4 D.C4H6
查看答案和解析>>
科目:高中化学 来源: 题型:
根据热化学方程式S(s)+O2(g)===SO2(g)
ΔH=-297.23 kJ·mol-1,分析下列说法中正确的是( )
①S(g)+O2(g)===SO2(g) ΔH=-Q,Q值大于297.23 kJ·mol-1 ②S(g)+O2(g)===SO2(g) ΔH=-Q,Q值小于297.23 kJ·mol-1 ③1 mol SO2的键能总和大于1 mol S与1 mol O2的键能总和 ④1 mol SO2的键能总和小于1 mol S与1 mol O2的键能总和
A.①③ B.②④ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
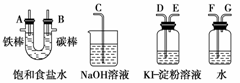
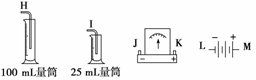
A极发生的电极反应式是_______________________________________________;
B极发生的电极反应式是_____________________________________________。
(2)电源、电流表与A、B两极的正确连接顺序为
L→( )→( )→( )→( )→M
(3)设计检测上述气体实验装置时,各接口的正确连接顺序为____接____、____接A,B接____、____接____。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
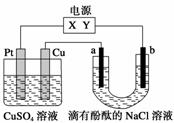
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl-—→Cl2↑+2e-
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点:A(水面以下)、B(水面)、C(水面以上)。问:
(1)A、B、C三点哪点腐蚀最快?
(2)若向蒸馏水中加入少量食盐,B处的腐蚀速率将如何变化?
(3)若将蒸馏水换成:①0.1 mol·L-1 H2SO4溶液; ②1 mol·L-1H2SO4溶液;③18.4 mol·L-1H2SO4溶液,则A处腐蚀由快到慢的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃ 时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应
后溶液的pH如下表:
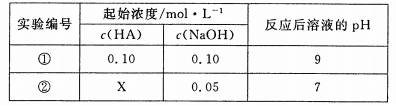
下列判断不正确的是
A、X>0.05
B、将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大
C、实验①所得溶液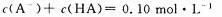
D、实验②所得溶液: 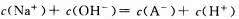
查看答案和解析>>
科目:高中化学 来源: 题型:
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s) Sr2+(aq)+S(aq) Ksp=2.5×10-7
Sr2+(aq)+S(aq) Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+C
Sr2+(aq)+C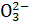 (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 。
(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大C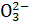 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”):
①升高温度,平衡常数K将 ;
②增大C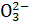 的浓度,平衡常数K将 。
的浓度,平衡常数K将 。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为 ;实验现象及其相应结论为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com