
| A. | 用米汤检验碘盐中的碘 | |
| B. | 用热的烧碱溶液洗涤餐具上的油污 | |
| C. | “地沟油”禁止食用,但可用来制取肥皂 | |
| D. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 |
分析 A.淀粉遇碘变蓝色;
B.一般不用烧碱,因烧碱具有强腐蚀性;
C.地沟油主要成分为油脂,可发生造化反应;
D.洁厕灵与84消毒液混合使用可生成有毒气体氯气.
解答 解:A.淀粉遇碘变蓝色,淀粉与碘酸钾不反应,故A错误;
B.一般不用烧碱,因烧碱具有强腐蚀性,可用纯碱溶液,故B错误;
C.地沟油主要成分为油脂,可发生造化反应,可用于制备肥皂,故C正确;
D.洁厕灵与84消毒液混合使用可生成有毒气体氯气,易中毒,故D错误.
故选C.
点评 本题考查较为综合,涉及油脂的组成、淀粉的性质、氯气的化学性质,题目难度中等,注意掌握常见的有机物结构与性质,明确氯水的性质及应用,题目有利于培养学生良好的科学素养.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
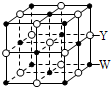 X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题:
X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
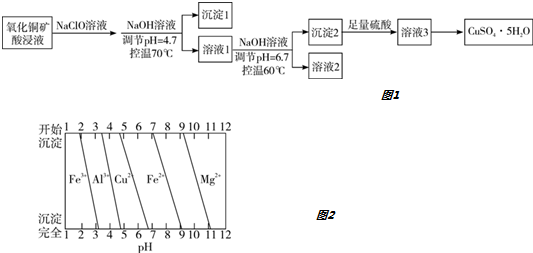
| A. | 沉淀1的主要成分为Al(OH)3和Fe(OH)3 | |
| B. | 溶液2中所含金属阳离子只有Mg2+ | |
| C. | 将溶液3蒸干即得CuSO4•5H2O晶体 | |
| D. | 若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO | B. | NH3 | C. | H2O2 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
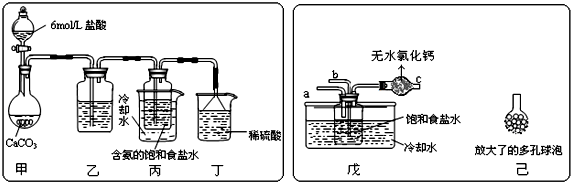
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com