
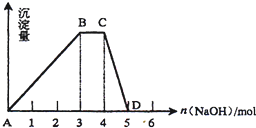
分析 (1)R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,说明含有铝离子,最终剩余沉淀甲甲不溶于稀盐酸为硫酸钡沉淀,因此R中含有硫酸根离子;另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224L(标准状况),乙能使湿润的红色石蕊试纸变蓝,因此乙是氨气,则R中含铵根离子;据此推断得出结论.
(2)从图象可看出,沉淀达到最大量耗氢氧化钠3mol,根据反应Al3++3OH-═Al(OH)3↓可知铝离子物质的量为1mol,所以R的物质的量为1mol,由此可计算R的浓度;铵根离子和碱反应生成一水合氨,故沉淀无变化;CD段为氢氧化铝溶解的反应,据此分析.
解答 解:(1)R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,说明含有铝离子,最终剩余沉淀甲4.66g为硫酸钡沉淀,物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,因此含有硫酸根离子;B取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224L(标准状况)物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,乙能使湿润的红色石蕊试纸变蓝,因此乙是氨气,则R中含铵根离子;因此R为:NH4Al(SO4)2,故答案为:NH4Al(SO4)2;BaSO4;
(2)从图象可看出,沉淀达到最大量耗氢氧化钠3mol,根据反应Al3++3OH-═Al(OH)3↓可知铝离子物质的量为1mol,所以R的物质的量为1mol,R的物质的量浓度为:$\frac{1mol}{0.5L}$=2mol/L;铵根离子和碱反应生成一水合氨,故沉淀无变化;CD段为Al(OH)3与NaOH反应,沉淀逐渐溶解,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:2mol/L;NH4+与OH-生成NH3•H2O;Al(OH)3与NaOH反应,沉淀逐渐溶解,Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了化学式的推断,离子方程式的书写及计算.解题关键是根据现象推断出R所含离子,看图象时要注意坐标的含义,分清发生的反应.本题中的有些数据可以不用,根据现象定性推断即可,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | $\frac{53}{84}$<a<$\frac{53}{62}$ | |
| B. | a=$\frac{53}{65}$时,m2中固体为Na2CO3和NaOH | |
| C. | a=$\frac{53}{75}$时,m2中固体为Na2CO3 | |
| D. | 若m1=58.4,m2=56.6,则m1中NaHCO3为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
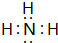 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程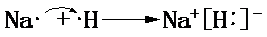 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2通入氨水和硝酸钡的混合溶液中产生白色沉淀,说明NO3-将SO2氧化生成了硫酸钡 | |
| B. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| C. | 为除去乙酸乙酯中混有的少量乙酸杂质,可向混合溶液中加入适量的乙醇并加热 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 既是氧化剂,又是还原剂 | |
| B. | Fe2O3在反应中得到电子 | |
| C. | 3 mol Na2O2参加反应,转移的电子总数为12mol | |
| D. | Na2FeO4能消毒杀菌,因其具有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com