
分析 根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式,据此进行分析.
解答 解:稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液分别是强酸、强碱,则反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
点评 本题考查热化学方程式书写,明确中和热指的是酸碱中和反应生成1mol液态水时放出57.3kJ的热量,题目难度大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
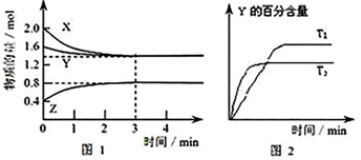
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L•min) | |
| C. | 据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 | |
| B. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3 COO -) | |
| C. | 在氯水中通入氯化氢气体后,溶液中c(HClO)减小 | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )| A. | 该过程所涉及的反应均为氧化还原反应 | |
| B. | 当X单质为金属时,可能是Na或Fe | |
| C. | 当X单质为非金属时,可能是F2或 C | |
| D. | 反应①可能在常温下进行,也可能需要在高温下才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 2:6:3 | C. | 3:2:1 | D. | 1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、I-、SO${\;}_{4}^{2-}$ | B. | OH-、Na+、HCO${\;}_{3}^{-}$、Cl- | ||
| C. | K+、Ca2+、NO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$ | D. | K+、Na+、OH-、AlO${\;}_{2}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯和苯在工业上都可以通过石油分馏得到 | |
| B. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| C. | 甲烷、乙烯、乙醇都能发生氧化反应 | |
| D. | 汽油、柴油属于烃,植物油属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com