
 如图,A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质.在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应.且B的相对分子质量小于D.
如图,A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质.在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应.且B的相对分子质量小于D.
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 下列有关实验的操作、现象和原理,正确的是( )
下列有关实验的操作、现象和原理,正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
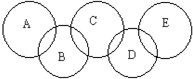 如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质.一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D.请填空:
如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质.一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中A、B、C、D是同周期或同主族的相邻元素:
如图中A、B、C、D是同周期或同主族的相邻元素:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
(1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com