
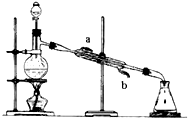
 如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.
如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:| 实验编号及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2?g-1 |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | ||||||
| 实验5目的: | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由2Cu+O2═2CuO可推出同族的硫也有Cu+S═CuS |
| B、Fe3O4可表示为FeO?Fe2O3,则Pb3O4可表示为PbO?Pb2O3 |
| C、Na能与水反应生成H2,K、Ca也能与水反应生成H2 |
| D、CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
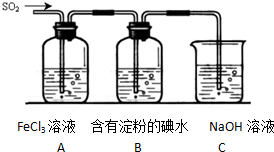
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测得氯水的pH值 |
| B、葡萄糖银镜反应实验后的试管内壁附有银,可用氨水清洗 |
| C、将AlCl3溶液蒸发结晶提取无水AlCl3 |
| D、欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com