
分析 (1)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大;
B、根据溶液中电荷守恒判断;
C、根据题意知NaHA溶液呈酸性,Na2A溶液呈碱性,则向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量;
D、根据题意知NaHA溶液呈酸性,Na2A溶液呈碱性,则向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于KOH的体积,据此确定钠离子和钾离子浓度之和;
(2)先不考虑水解,则c.(NH4)2SO4含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,NH3•H2O,溶液中c(NH4+)小于铵盐的c(NH4+),NH4HSO4溶液中氢离子抑制铵根离子水解,根据盐类的水解角度分析解答;
(3)根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)计算,质子守恒为c(H+)=c(MOH)+c(OH-),溶液PH=6,计算溶液中氢离子浓度和氢氧根离子浓度,计算得到有关离子浓度;
(4)若处理后的废水中残留的c(Fe3+)=2×10-13mol•L-1,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25mol/L,则残留的Cr3+的浓度依据Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)计算.
解答 解:(1)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数也未知,故A错误;
B、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HA-)+2c(A2-),故B正确;
C、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故C正确;
D、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故D错误;
故答案为:BC;
(2)先不考虑水解,则c.(NH4)2SO4含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,NH3•H2O,溶液中c(NH4+)小于铵盐的c(NH4+),NH4HSO4溶液中氢离子抑制铵根离子水解,c(NH4+)由大到小的顺序为:c.b.a.d,
故答案为:c.b.a.d;
(3)混合溶液的pH=6,c(H+)=10-6mol/l,离子积常数计算得到氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8mol/L,根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol•L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol•L-1,
故答案为:9.9×10-7; 10-8;
(4)若处理后的废水中残留的c(Fe3+)=2×10-13mol•L-1,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25mol/L,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.0×10-31 ,c(Cr3+)=3×10-6mol•L-1,
故答案为:3×10-6mol•L-1.
点评 本题考查了盐溶液酸碱性的判断、溶液中离子浓度的关系、外界条件对化学平衡的影响、氧化还原反应计算应用,溶度积的计算应用等知识点,难度较大,根据温度、电解质溶液对难溶物性质的影响和电荷守恒、物料守恒来分析解答即可.


科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
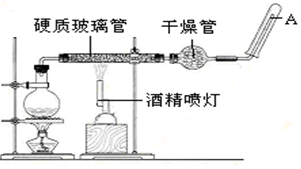
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,电池负极周围溶液的c(OH-)为断增大 | |
| B. | 电池放电时,H2是负极 | |
| C. | 电池放时时,氢元素被氧化 | |
| D. | 电池放电时,镍元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
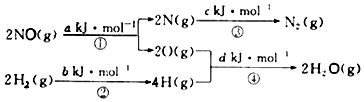
| A. | 0.5(a+b-c-d)kJ/mol | B. | 0.5(c+a-d-b)kJ/mol | ||
| C. | 0.5(c+d-a-b)kJ/mol | D. | 0.5(c+d-a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
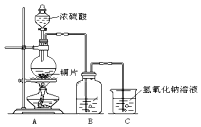 如图为足量铜与浓硫酸反应的装置.请回答:
如图为足量铜与浓硫酸反应的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
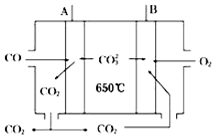 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L含24.5gH2SO4的溶液 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1LH2SO4溶液中含98gH2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com