
0.1 mol有机物的蒸气跟过量O2混合后点燃,生成13.2 g CO2和5.4 g H2O,该有机物跟金属钠
反应放出H2;又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物。该酯类化合物的结构简式可能是( )
A.CH3CH(OCH3)CHO B.OHCCH2COOCH2CH3
C.CH3COOCH(CH3)CHO D.CH3COOCH2CH2COCH3
科目:高中化学 来源:物理教研室 题型:013
1 mol该有机物与足量NaOH溶液共热,充分反应最多可消耗a mol NaOH,将所得溶液蒸干后再与足量碱石灰共热,又消耗b mol NaOH,则a与b的值分别是( )
A.5 mol、10 mol B.6 mol、2 mol
C.8 mol、4 mol D.8 mol、2 mol
查看答案和解析>>
科目:高中化学 来源:四川省成都石室中学2012届高三上学期期中考试理综化学试题 题型:022
Ⅰ
、2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性分子可用作某些化学反应的催化剂,为合成对人类有用的重要化学物开辟了一个全新的研究领域.在有机物分子中,若某个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在.某链烃C7H10c的众多同分异构体中:
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在.某链烃C7H10c的众多同分异构体中:
(2)
处于同一平面上的碳原子数最多有________.A.
6个B.5
个C.7
个D.
4个(3)
含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的有5种.它们的结构简式除(3)含有“手性碳原子”,但与足量
H2发生加成反应后,不具有“手性碳原子”的结构简式是________Ⅱ、
乙烷与某烃的混合气体1.344 L(标准状况)与足量的氧气混合点燃,完全燃烧后所得气体通入300 mL 0.4 mol·L的NaOH溶液中被全部吸收,然后将吸收液低温蒸干,得固体7.6 g.(1)7.6 g
固体的成分是________.(2)
该混合气体中除C2H6外,另一种烃是________.(3)
该混合气体中C2H6,队的物质的量是________,另一种烃的物质的量是________.(4)
若将该混合气体在足量氧气中完全燃烧后的产物通过足量的Na2O2粉末,Na2O2粉末增重的质量为________.查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市泗水一中高二3月月考化学试卷(带解析) 题型:实验题
(9分)实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr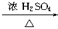 C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。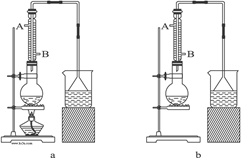
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是( )
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_______ _________。
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林中学高二上学期期末理科化学试卷(解析版) 题型:计算题
某有机物A只含有一个氧原子。将0.1 mol A在足量氧气中完全燃烧产生3.6g水,产物还能与100 mL 2mol/L烧碱溶液恰好完全反应,将所得溶液在低温下蒸干,能得到16.8g纯净物。请计算:①A的分子式;②若A的核磁共振氢谱只有一个吸收峰,请写出A的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
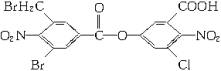
、氰乙酸乙酯是精细化工的重要原料。此物质为有毒的液体,不溶于水,溶于碱溶液,与乙醇、乙醚等有机物混溶。
合成该物质是以A为起始物,经下列变化得到:
HClO Na2CO3 NaCN HCl A
A ① B ② C ③ D ④ E ⑤ F ⑥ G ⑦ 氰乙酸乙酯
已知:RCH=CH2 + HClO RCHClCH2OH ,
RCH2Cl + NaCN RCH2CN + NaCl 。
(1) a. ①的反应条件为 ;
b. 上述属于加成反应的是 ;属于取代反应的是 。(填序号)
c. ④的反应方程式为 。
(2)⑤的操作过程为:将NaCN 溶于水加热至50℃~60℃,然后滴入E溶液,温度在3min~5min内自然升到70℃,控制升温速度,维持80℃~90℃至反应结束。
a. E F反应为 反应(填“吸热”或“放热”)。
b.如何控制升温速度 。
(3) G与A、硫酸混合共沸蒸馏,蒸去反应生成的水及过量的A 至内温达到110℃,降温到40℃,得到氰乙酸乙酯的粗产品。粗产品中加入 溶液,静置后,进行 操作,然后再进行常压蒸馏和减压蒸馏,即可得到成品氰乙酸乙酯。
(4)产品中氰乙酸乙酯的含量≥92%为合格产品。产品含量的测定方法:称取样品1.000g置于锥形瓶中,用滴定管准确加入50mL 0.5 mol/L氢氧化钾乙醇溶液,置于沸水浴中回流1.5h,用10mL新煮沸的蒸馏水冲洗冷凝管内壁,冷却后,加入2滴1%酚酞乙醇指示剂,以0.5mol/L盐酸溶液滴定至粉红色消失,此时耗盐酸35.00mL。
a.能否用托盘天平称取样品 (填“能”或“不能”),理由是 。
b.该样品合格吗?(通过计算说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com