
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
(1)NaOH、Na2CO3(共2分,各1分)
(2)Na2CO3>NaCl(2分,“>”用“、”也可)
(3)CO32—+2CH3COOH= 2CH3COO—+CO2↑+H2O(3分,没配平扣1分)
(4)c(Na+)>c(CH3COO—)>c(OH—)>c(H+)(3分)
解析试题分析:NaOH、CH3COOH抑制水电离,有可能两溶液中水的电离程度相同,又Na2CO3、NaOH溶液呈碱性,有可能两溶液的pH相同,所以X是NaOH溶液,Y是CH3COOH,Z是Na2CO3,W是NaCl。⑴X是NaOH溶液,Z是Na2CO3,答案:NaOH、Na2CO3;⑵Na2CO3水解促进水电离,所以Na2CO3溶液中水的电离程度大于NaCl,答案;Na2CO3>NaCl; ⑶Na2CO3与过量的CH3COOH反应的离子方程式为:CO32—+2CH3COOH= 2CH3COO—+CO2↑+H2O,答案:CO32—+2CH3COOH= 2CH3COO—+CO2↑+H2O;⑷X、Y两溶液恰好完全反应后,溶液实际上是CH3COONa溶液,CH3COO—少量水解,CH3COO―+H2O CH3COOH+OH―,水解后溶液呈碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(CH3COO—)>c(OH—)>c(H+),答案:c(Na+)>c(CH3COO—)>c(OH—)>c(H+)。
CH3COOH+OH―,水解后溶液呈碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(CH3COO—)>c(OH—)>c(H+),答案:c(Na+)>c(CH3COO—)>c(OH—)>c(H+)。
考点:元素及其化合物、电解质溶液中离子浓度大小比较


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:填空题
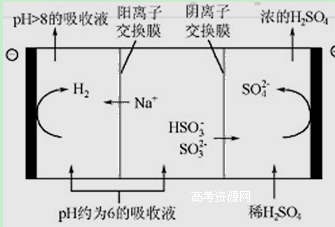
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10–9 | 6.8×10–6 | 5.5×10–6 | 1.8×10–11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H+ + S042-。
H+ + S042-。
请回答下列有关问题:
(1)Na2SO4溶液呈_(填“弱酸性”、“中性”或“弱碱性”),其理由是_
(用离子方程式表示)。
(2)H2SO4溶液与BaC12溶液反应的离子方程式为_ 。
(3)在0.l0mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是_ (填写编号)。
| A.c(Na+)=c(SO42-)+c(HSO4一)+c(H2SO4) |
| B.c(OH-)="c(" HSO4-)+c(H+) |
| C.c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c( Na+)=2c(SO42-)+2c(HSO4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
[14分]已知:I2+2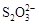

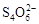 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
A移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B用标准NaOH溶液润洗滴定管2~3次
C把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的 (选填:“甲”、“乙”)。
(2)正确的操作顺序是 (填字母序号)。
(3)上述B步操作的目的是 。
(4)判断到达滴定终点的实验现象是 。
(5)上述A步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是 (填“偏大”或“偏小”或“无影响”)。
(6)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com