
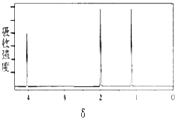
| A. | CH3-CH2-CH3 | B. | CH3CH2 CH2Br | C. | 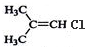 | D. | 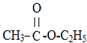 |
分析 根据核磁共振氢谱有几种吸收峰,故有机物分子中有几种H原子,峰的面积之比等于氢原子的个数之比,结合等效氢判断.
解答 解:核磁共振氢谱中给出3种峰,说明该分子中有3种H原子,
A.CH3CH2CH3中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为3:1,故A错误;
B、CH3CH2 CH2Br中有3种氢原子,核磁共振氢谱中有3种峰,面积之比为3:2:2,故B错误,
C、 中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为6:1,故C错误;
中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为6:1,故C错误;
D、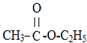 有3种氢原子,核磁共振氢谱中有3种峰,面积之比为3:3:2,故D正确;
有3种氢原子,核磁共振氢谱中有3种峰,面积之比为3:3:2,故D正确;
故选D.
点评 本题考查核磁共振氢谱,难度不大,清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数是解题的关键.


科目:高中化学 来源: 题型:填空题
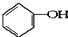 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
 的分子式:C6H6O
的分子式:C6H6O 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当加热 | B. | 改用锌粉 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量1mol•L-1稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量Na2CO3固体 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量NaOH固体 | D. | 加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
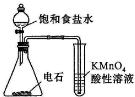
| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属 | B. | 周期表右上角非金属元素 | ||
| C. | 金属与非金属分界线附近的元素 | D. | 过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
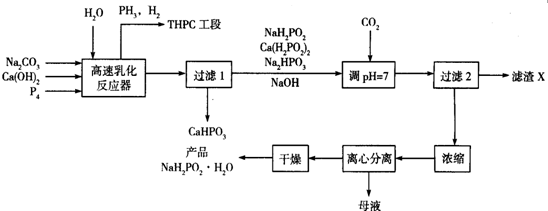
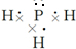 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com