
【题目】已知下列三种气态物质之间的反应:
C2H2(g)+H2(g)![]() C2H4(g)①
C2H4(g)①
2CH4(g)![]() C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)=CH4(g) ΔH=-Q1kJ/mol
C(s)+![]() H2(g)=
H2(g)=![]() C2H2(g) ΔH=-Q2kJ/mol
C2H2(g) ΔH=-Q2kJ/mol
C(s)+H2(g)=![]() C2H4(g) ΔH=-Q3kJ/mol
C2H4(g) ΔH=-Q3kJ/mol
Q1、Q2、Q3均为正值,下列关系正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
【答案】A
【解析】试题分析:其它条件保持不变时,降温能使平衡向吸热方向移动,由题意可知,①②的正反应分别为放热反应、吸热反应,则①C2H2(g)+H2(g)![]() C2H4(g) ΔH < 0,②2CH4(g)
C2H4(g) ΔH < 0,②2CH4(g)![]() C2H4(g)+2H2(g) ΔH > 0,两式相减可得:③C2H2(g)+3 H2(g)
C2H4(g)+2H2(g) ΔH > 0,两式相减可得:③C2H2(g)+3 H2(g)![]() 2CH4(g) ΔH < 0,系数减半可得:
2CH4(g) ΔH < 0,系数减半可得:![]() C2H2(g)+
C2H2(g)+![]() H2(g)
H2(g)![]() CH4(g) ΔH < 0;先由C(s)+2 H2(g)=CH4(g) ΔH=-Q1kJ/mol、C(s)+
CH4(g) ΔH < 0;先由C(s)+2 H2(g)=CH4(g) ΔH=-Q1kJ/mol、C(s)+![]() H2(g)=
H2(g)=![]() C2H2(g) ΔH=-Q2kJ/mol两式相减可得:
C2H2(g) ΔH=-Q2kJ/mol两式相减可得:![]() C2H2(g)+
C2H2(g)+![]() H2(g)
H2(g)![]() CH4(g) ΔH = [(-Q1)-(-Q2)]kJ/mol < 0,则(-Q1)-(-Q2)< 0,解得:Q2 < Q1或Q1 > Q2;再由C(s)+H2(g)=
CH4(g) ΔH = [(-Q1)-(-Q2)]kJ/mol < 0,则(-Q1)-(-Q2)< 0,解得:Q2 < Q1或Q1 > Q2;再由C(s)+H2(g)=![]() C2H4(g) ΔH=-Q3kJ/mol、C(s)+
C2H4(g) ΔH=-Q3kJ/mol、C(s)+![]() H2(g)=
H2(g)=![]() C2H2(g) ΔH=-Q2kJ/mol两式相减可得:
C2H2(g) ΔH=-Q2kJ/mol两式相减可得:![]() C2H2(g)+
C2H2(g)+![]() H2(g)=
H2(g)=![]() C2H4(g) ΔH=[(-Q3)-(-Q2)]kJ/mol,系数加倍可得:C2H2(g)+H2(g)
C2H4(g) ΔH=[(-Q3)-(-Q2)]kJ/mol,系数加倍可得:C2H2(g)+H2(g)![]() C2H4(g) ΔH=2[(-Q3)-(-Q2)]kJ/mol < 0,则2[(-Q3)-(-Q2)] < 0,解得:Q2< Q3或Q3> Q2;然后由C(s)+H2(g)=
C2H4(g) ΔH=2[(-Q3)-(-Q2)]kJ/mol < 0,则2[(-Q3)-(-Q2)] < 0,解得:Q2< Q3或Q3> Q2;然后由C(s)+H2(g)=![]() C2H4(g) ΔH=-Q3kJ/mol、C(s)+2 H2(g)=CH4(g) ΔH=-Q1kJ/mol两式相减可得:CH4(g)=H2(g)+
C2H4(g) ΔH=-Q3kJ/mol、C(s)+2 H2(g)=CH4(g) ΔH=-Q1kJ/mol两式相减可得:CH4(g)=H2(g)+![]() C2H4(g) ΔH=[(-Q3)-(-Q1)]kJ/mol,系数加倍可得:2CH4(g)
C2H4(g) ΔH=[(-Q3)-(-Q1)]kJ/mol,系数加倍可得:2CH4(g)![]() C2H4(g)+2H2(g) ΔH=2[(-Q3)-(-Q1)]kJ/mol > 0,则2[(-Q3)-(-Q1)] > 0,解得:Q1> Q3;答案选A。
C2H4(g)+2H2(g) ΔH=2[(-Q3)-(-Q1)]kJ/mol > 0,则2[(-Q3)-(-Q1)] > 0,解得:Q1> Q3;答案选A。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述,错误的是
A. 镁是第IIA族元素
B. 第IA族元素全部是金属元素
C. 氧族中含金属元素
D. 第3周期中既有金属元素又有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COOH溶液中存在如下平衡:CH3COOHCH3COO-+H+。加入少量下列物质或采取下述方法,能使平衡逆向移动的是( )
A. 加水 B. 升温
C. CH3COONa固体 D. NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝 | Cl2具有氧化性 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体总物质的量增大的方向移动;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A. ①④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入SO2将溶液分置于两支试管中,向一份中加入NaOH溶液,出现白色沉淀A,另一份通入少量Cl2 , 产生白色沉淀B,试回答下列问题:
(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”.此处应为 , 原因是 .
(2)沉淀A的化学式为 , 该沉淀能否溶于稀盐酸? .
(3)写出生成沉淀B的离子方程式: .
(4)生成2.33 g沉淀B,需消耗标准状况下的Cl2mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol。
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线_____。
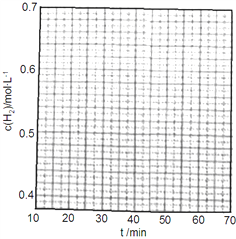
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是_____(填增大、减少或不变)。
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式______________________。
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01 mol·L-1 N2H4水溶液的pH等于__________(忽略N2H4的二级电离和H2O的电离)。
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(I) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______。
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。
![]()
实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.HF溶于少量水中:HF+H2OF﹣+H3O+
B.H2S溶于水:H2S2H++S2﹣
C.Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣
D.NaHSO4熔融:NaHSO4═Na++H++SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com