
下列说法正确的是
A.可利用过滤的方法区别溶液和胶体
B.制备Fe(OH)3胶体通常是将Fe(OH)3固体溶于沸水
C.直径介于1nm~100nm之间的微粒称为胶体
D.电泳现象证明胶体粒子是带电的
科目:高中化学 来源:2015-2016学年江西省高一上第一次月考化学试卷(解析版) 题型:填空题
某白色粉末由K2SO4、Na2CO3、NaCl和BaCl2中的两种或两种以上物质组成。为了鉴别该粉末的成分,某探究小组做了如下实验。
①取少量粉末溶于水,有白色沉淀生成。
②取少量粉末加入稀盐酸,有无色无味的气体产生。
根据上述实验现象回答下列问题:
(1)该粉末中一定含有 ,可能含有 。
(2)步骤②中反应的化学方程式为 。
(3)为了确定沉淀的成分,需要进行的操作是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下表是几种电解质的电离常数(25℃)
 电解质的强弱判断正确的是
电解质的强弱判断正确的是
A.e最弱
B.b最强
C.由强到弱的顺序为a> b> d >e >c
D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高二上学期期中测试化学试卷(解析版) 题型:填空题
(2013秋•兰山区期中)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
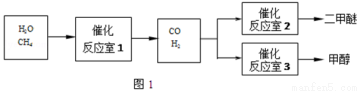
请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g)═CO(g)+3H2(g)△H>0.其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).
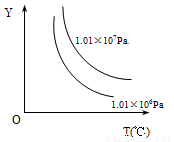
(2)图1中反应室3(容积可变的密闭容器)中0.2mol CO与0.4mol H2在催化剂作用下发生可逆反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
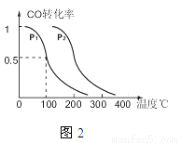
①P1 P2 (填“<”、“>”或“=”).
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时CO平衡常为 , 若温度不变,再加入1.0mol CO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”).
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2mol CO与0.4mol H2,CO的平衡转化率 (填“增大”、“不变”或“减小”).
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第一次月考化学试卷(解析版) 题型:实验题
人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
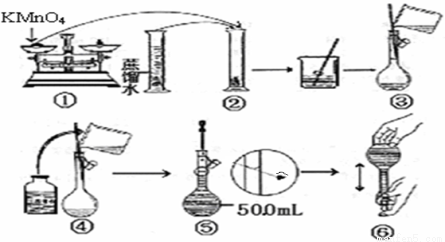
(1)上述过程中有两处错误,请你观察图示,判断其中不正确的操作是(填序号)____________;
(2)如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时,盛放高锰酸钾器名称为________________,确定反应达到终点的现象________________。
(4)草酸跟酸性KMnO4溶液反应的离子方程式为:_______________________。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上学期期中测试化学试卷(解析版) 题型:选择题
将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是:
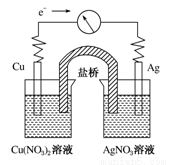
A、KNO3盐桥中的K+移向Cu(NO3)2溶液
B、Cu作负极,发生还原反应
C、电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D、工作一段时间后,AgNO3溶液中c(Ag+)减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:选择题
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
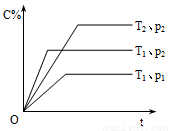
A.反应物A的转化率 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.该反应的正方向的∆H>0
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期第三次测试化学试卷(解析版) 题型:选择题
下列变化过程不涉及氧化还原反应的是
A.将一小块钠放在石棉网上加热,生成淡黄色物质
B.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色
C.向纯碱溶液中滴加酚酞,溶液变红色
D.向氢碘酸中滴加FeCl3溶液,产生棕色物质
查看答案和解析>>
科目:高中化学 来源:2016届江西省高安市高三上学期第二次段考化学试卷(解析版) 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式___ _____。
(2)已知:Se + 2H2SO4(浓) → 2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O → Se + 2SO42- + 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目________________________________。
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com