
分析 (1)还原性:Fe2+>Br-,x=$\frac{n}{2}$时,亚铁离子恰好被氧化,则x≤$\frac{n}{2}$时,氯气不足,只有亚铁离子被氧化;
(2)由2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-可知,亚铁离子、溴离子均全部被氧化,以此来解答.
解答 解:(1)还原性:Fe2+>Br-,x=$\frac{n}{2}$时,由电子守恒可知亚铁离子恰好被氧化,则x≤$\frac{n}{2}$时,氯气不足,只有亚铁离子被氧化,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)由2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-可知,亚铁离子、溴离子均全部被氧化,由电子守恒可知恰好完全被氧化时存在x×2=n+2n,则x与n的关系为x≥$\frac{3}{2}$n,
故答案为:x≥$\frac{3}{2}$n.
点评 本题考查氧化还原反应的计算,为高频考点,把握还原性的强弱及电子守恒为解答的关键,侧重分析、应用及计算能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素在人体内均可水解生成葡萄糖 | |
| B. | 溴乙烷在浓硫酸、加热的条件下发生消去反应生成乙烯 | |
| C. | 乙烯、苯分子中都含有碳碳双键,都能发生加成反应 | |
| D. | 饱和Na2SO4溶液和浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
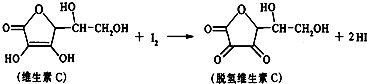
| A. | 上述反应为取代反应 | B. | 滴定时应剧烈振荡锥形瓶 | ||
| C. | 滴定时可用淀粉溶液作指示剂 | D. | 维生素C的分子式为C6H6O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池工作时,正极反应为:2AgCl+2e-═2Cl-+2Ag | |
| B. | 镁电极作该电池负极,负极反应为:Mg-2e-═Mg2+ | |
| C. | 当有24g Mg被氧化时,有108 g AgCl被还原 | |
| D. | 装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与液溴制溴苯的反应: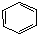 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$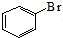 +HBr +HBr | |
| B. | 乙酸与乙醇的酯化反应:CH3COOH+CH3CH2${\;}_{\;}^{18}$OH$→_{△}^{浓H_{2}SO_{4}}$CH3CO${\;}_{\;}^{18}$OCH2CH3+H2O | |
| C. | 溴乙烷与NaOH水溶液混和共热 CH3CH2Br+NaOH$→_{△}^{水}$CH2=CH2+H2O+NaBr | |
| D. | 乙醇的消去反应 CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4 L的CCl4中含有NA个分子 | |
| B. | 1 mol Cl2溶于足量水中一定转移NA个电子 | |
| C. | 18 g 18O2和18O3中一共含有NA个18O原子 | |
| D. | 1 mol•L-1的NaOH溶液中共含有NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
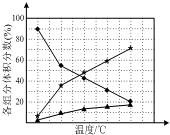 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com