
某烷烃的一种同分异构体只能生成一种一氯代物,则该烃的分子式不可能的是( )
A.CH4 B.C2H6
C.C4H10 D.C5H12
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
(1)市场上销售的香肠、盐水鸭、榨菜、豆腐干等食品,常用真空包装。真空包装的目的是除去空气,使大多数微生物因缺少________而受到抑制,停止繁殖,同时防止食品发生缓慢________而变质。
(2)茶叶、肉松、膨化食品等常采用真空充气包装,即将食品装入包装袋,抽出包装袋内空气,再充入防止食品变质的气体,然后封口。真空充气包装能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形。
提出问题:充入食品包装袋中的气体是什么?
猜想与验证:可能是________。实验初步验证的方法及现象:________________________________________________________________________。
充入的气体还可能是:①________;②________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g) CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于x的是 ( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于x的是 ( )
A.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
B.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
D.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化学中的反应类型较多,将下列反应归类。(填写序号)
①由乙烯制氯乙烷 ②乙烷在氧气中燃烧 ③乙烯使溴的四氯化碳溶液褪色 ④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯 ⑥甲烷与氯气在光照的条件下反应
其中属于取代反应的是__________;属于氧化反应的是__________;属于加成反应的是____________;属于聚合反应的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关简单的烷烃的叙述:①都是易燃物;②特征反应是取代反应;③相邻两个烷烃在分子组成上相差一个甲基,其中正确的是( )
A.①和③ B.②和③
C.只有① D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
室内空气污染的主要来源之一是现代人的生活中使用的化工产品。如泡沫绝缘材料的办公用品、化纤地毯及书报、油漆等不同程度释放出的气味。该气体可能是( )
A、甲醛 B、甲烷 C、一氧化碳 D、二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S△,Na2S2O3。常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图1所示。
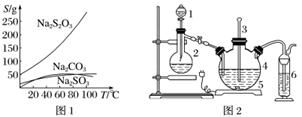
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按图2连接好装置。
(1)仪器2的名称为________________,装置6中可放入________________(填字母)。
A.BaCl2溶液
B.浓H2SO4
C.酸性KMnO4溶液
D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为
①Na2CO3+SO2===Na2SO3+CO2
②Na2S+SO2+H2O===Na2SO3+H2S
③2H2S+SO2===3S↓+2H2O
④Na2SO3+S△,Na2S2O3
总反应为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时至固体消失,即可停止通气和加热。若继续通入SO2,又会析出浅黄色沉淀,写出此时发生反应的离子方程式:________________________________________________。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
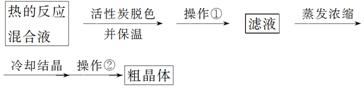
(1)为减少产品的损失,操作①为________,操作②是抽滤洗涤干燥,其中洗涤操作是用________________(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高________________________________________________________________________。
(3)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。KMnO4溶液应置于________(填“酸式”或“碱式”)滴定管中。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com